INTRODUÇÃO À QUÍMICA ORGÂNICA
Qual a ordem decrescente de reatividade em condições de SN2 para os seguintes substratos:
1-cloro-2-metilbutano
2-cloro-2-metilbutano
1-cloro-3metilbutano
1-cloro-pentano
2-cloro-2-metilbutano, 1-cloro-2-metilbutano, 1-cloro-3-metilbutano, 1-cloro-pentano
1-cloro-3-metilbutano, 1-cloro-2-metilbutano, 2-cloro-2-metilbutano, 1-cloro-pentano
1-cloro-pentano, 1-cloro-3-metilbutano, 1-cloro-2-metilbutano, 2-cloro-2-metilbutano
1-cloro-pentano, 1-cloro-2-metilbutano, 2-cloro-2-metilbutano, 1-cloro-3-metilbutano
1-cloro-2-metilbutano, 1-cloro-3-metilbutano, 2-cloro-2-metilbutano, 1-cloro-pentano
Boa parte dos brasileiros apreciam uma boa cerveja, enquanto para alguns o seu gosto seja repugnante dado o seu gosto amargo, o qual se deve à seguinte substância de fórmula estrutural plana:
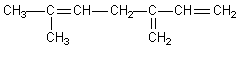 Essa substância, denominada de mirceno, é derivada das folhas de lúpulo adicionadas durante a fabricação da bebida. Analisando a estrutura anterior podemos afirmar que o número de ligações pi presentes no mirceno é:
Essa substância, denominada de mirceno, é derivada das folhas de lúpulo adicionadas durante a fabricação da bebida. Analisando a estrutura anterior podemos afirmar que o número de ligações pi presentes no mirceno é:
5
8
6
11
3
Vários grupamentos podem ser adicionados ao grupo carbonila por meio de reação de adição. Um dos grupos importantes de entrada no grupo carbonila é o cianeto (CN-). Escolha a alternativa correta em relação a esse íon.
O íon cianeto não é encontrado livre de seu cátion em soluções de cianeto de sódio preparadas para uso de laboratório.
Numa reação de adição o íon cianeto ataca o carbono nucleofilico do grupo carbonila, pois o íon cianeto é eletroílico.
O produto de uma reação com o íon cianeto é chamado de nitrila.
Borbulhar em água o gás cianídrico ou dissolver o sal cianeto de sódio em água.
O íon cianeto é considerado bastante eletrofílico.
Ésteres são compostos derivados de ácidos carboxílicos formados pela reação entre um álcool e um ácido carboxílico. Os ésteres de baixo peso molecular normalmente têm cheiro agradável. Podemos citar, como exemplo, as essências de abacaxi, framboesa e laranja. Um dos resultados obtidos com relação à essência de abacaxi, após a reação de um álcool e um ácido carboxílico, é:
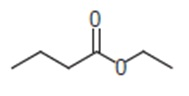 Analisando a reação acima, podemos afirmar que o álcool e o ácido carboxílico que a resultam são:
Analisando a reação acima, podemos afirmar que o álcool e o ácido carboxílico que a resultam são:
Ácido butanóico e etanol.
Ácido propanóico e metanol.
Ácido metanóico e butanol.
Ácido pentanóico e etanol.
Ácido butanóico e propanol.
Os compostos carbonilados podem ser atacados por um nucleófilo formando um intermediário tetraédrico como mostrado no esquema da reação abaixo. Com relação ao mecanismo proposto podemos afirmar que:
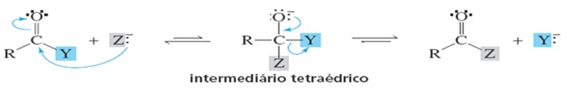
A base mais forte é preferencialmente eliminada por ser mais estável.
Se o grupo Z- for uma base mais fraca que Y, o intermediário tetraédrico irá preferencialmente eliminar o grupo Z e restaurar o reagente.
Os grupos Y- e Z- tiverem basicidade similares não ocorre eliminação de nenhum desses grupos.
O carbono da carbonila é um nucleófilo e podemos prever que será atacado por um eletrófilo.
O carbono da carbonila no reagente tem hibridação sp3 e o intermediário tetraédrico sp2.
As reações abaixo podem ocorrer através de substituições nucleofílicas do tipo Sn1 ou Sn2. A reação de substituição classificada como Sn1 ocorre via formação de carbocátion, e a Sn2, o nucleófilo faz o ataque por trás do grupo abandonador formando um produto com configuração invertida. Considerando os conceitos de substituição nucleofílica, com relação à classificação das reações 1 e 2 abaixo e a natureza do grupo abandonador cloro, pode-se afirmar que:
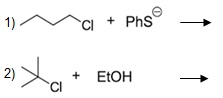
Sn1 e Sn2; o cloro é um bom grupo abandonador, pois forma uma base estável.
Sn1 e Sn1; o cloro sai na forma de Cl- e pode ser considerado uma base forte.
Sn2 e Sn1; o cloro sai na forma de Cl- pelo fato de ser uma base fraca.
Sn1 e Sn2; o cloro não é um bom grupo abandonador porque forma uma base instável.
Sn2 e Sn2; o cloro é um bom grupo abandonador, pois forma uma base estável.
Os ácidos carboxílicos são compostos orgânicos que apresentam o mais pronunciado caráter ácido, muito embora sejam considerados ácidos fracos. Quando em solução aquosa, liberam íon hidrônio ou hidroxônio, como a reação a seguir:
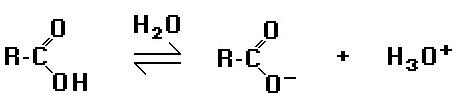 Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Propanóico.
Monocloro acético.
γ-iodo pentanóico.
Benzóico.
β-cloro butanóico.
O principal grupo funcional representante da basicidade dos compostos orgânicos são as aminas, que são compostos derivados da amônia (NH3) por substituição de um ou mais hidrogênios por radicais orgânicos. Com relação às aminas, analise as afirmações abaixo e assinale a alternativa que apresenta as afirmativas corretas.
I) O caráter básico destes compostos é consequência da existência de um par desemparelhado de elétrons sobre o átomo de nitrogênio.
II) a amina aromática mais simples denomina-se fenilamina ou anilina.
III) A benzilamina é uma amina isômera da metilfenilamina.
IV) Todas as aminas têm a propriedade de associar suas moléculas, formando pontes de hidrogênio.
V) A etilamina pode ser obtida pela reação de redução do cianeto de metila.
II, III, IV e V
I, II, IV e V
I, II, III e IV
I, II, III e V
Todas são corretas
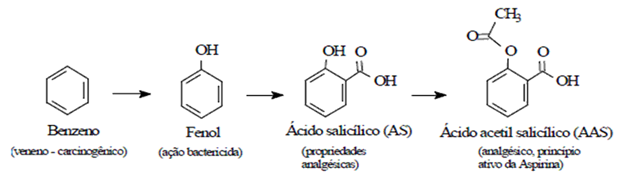
A química consegue, através de diversas reações, transformar o benzeno em muitos outros compostos e esses adquirem propriedades diferentes do benzeno graças as ligações pi (π), tendo então uma grande aplicação em nosso dia-a-dia. Sabendo disso, responda qual o número de ligações pi (π) no produto formado da síntese do AAS?
2-cloro-2-metilbutano, 1-cloro-2-metilbutano, 1-cloro-3-metilbutano, 1-cloro-pentano
1-cloro-3-metilbutano, 1-cloro-2-metilbutano, 2-cloro-2-metilbutano, 1-cloro-pentano
1-cloro-pentano, 1-cloro-3-metilbutano, 1-cloro-2-metilbutano, 2-cloro-2-metilbutano
1-cloro-pentano, 1-cloro-2-metilbutano, 2-cloro-2-metilbutano, 1-cloro-3-metilbutano
1-cloro-2-metilbutano, 1-cloro-3-metilbutano, 2-cloro-2-metilbutano, 1-cloro-pentano
Boa parte dos brasileiros apreciam uma boa cerveja, enquanto para alguns o seu gosto seja repugnante dado o seu gosto amargo, o qual se deve à seguinte substância de fórmula estrutural plana:
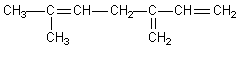 Essa substância, denominada de mirceno, é derivada das folhas de lúpulo adicionadas durante a fabricação da bebida. Analisando a estrutura anterior podemos afirmar que o número de ligações pi presentes no mirceno é:
Essa substância, denominada de mirceno, é derivada das folhas de lúpulo adicionadas durante a fabricação da bebida. Analisando a estrutura anterior podemos afirmar que o número de ligações pi presentes no mirceno é:
5
8
6
11
3
Vários grupamentos podem ser adicionados ao grupo carbonila por meio de reação de adição. Um dos grupos importantes de entrada no grupo carbonila é o cianeto (CN-). Escolha a alternativa correta em relação a esse íon.
O íon cianeto não é encontrado livre de seu cátion em soluções de cianeto de sódio preparadas para uso de laboratório.
Numa reação de adição o íon cianeto ataca o carbono nucleofilico do grupo carbonila, pois o íon cianeto é eletroílico.
O produto de uma reação com o íon cianeto é chamado de nitrila.
Borbulhar em água o gás cianídrico ou dissolver o sal cianeto de sódio em água.
O íon cianeto é considerado bastante eletrofílico.
Ésteres são compostos derivados de ácidos carboxílicos formados pela reação entre um álcool e um ácido carboxílico. Os ésteres de baixo peso molecular normalmente têm cheiro agradável. Podemos citar, como exemplo, as essências de abacaxi, framboesa e laranja. Um dos resultados obtidos com relação à essência de abacaxi, após a reação de um álcool e um ácido carboxílico, é:
 Analisando a reação acima, podemos afirmar que o álcool e o ácido carboxílico que a resultam são:
Analisando a reação acima, podemos afirmar que o álcool e o ácido carboxílico que a resultam são:
Ácido butanóico e etanol.
Ácido propanóico e metanol.
Ácido metanóico e butanol.
Ácido pentanóico e etanol.
Ácido butanóico e propanol.
Os compostos carbonilados podem ser atacados por um nucleófilo formando um intermediário tetraédrico como mostrado no esquema da reação abaixo. Com relação ao mecanismo proposto podemos afirmar que:

A base mais forte é preferencialmente eliminada por ser mais estável.
Se o grupo Z- for uma base mais fraca que Y, o intermediário tetraédrico irá preferencialmente eliminar o grupo Z e restaurar o reagente.
Os grupos Y- e Z- tiverem basicidade similares não ocorre eliminação de nenhum desses grupos.
O carbono da carbonila é um nucleófilo e podemos prever que será atacado por um eletrófilo.
O carbono da carbonila no reagente tem hibridação sp3 e o intermediário tetraédrico sp2.
As reações abaixo podem ocorrer através de substituições nucleofílicas do tipo Sn1 ou Sn2. A reação de substituição classificada como Sn1 ocorre via formação de carbocátion, e a Sn2, o nucleófilo faz o ataque por trás do grupo abandonador formando um produto com configuração invertida. Considerando os conceitos de substituição nucleofílica, com relação à classificação das reações 1 e 2 abaixo e a natureza do grupo abandonador cloro, pode-se afirmar que:

Sn1 e Sn2; o cloro é um bom grupo abandonador, pois forma uma base estável.
Sn1 e Sn1; o cloro sai na forma de Cl- e pode ser considerado uma base forte.
Sn2 e Sn1; o cloro sai na forma de Cl- pelo fato de ser uma base fraca.
Sn1 e Sn2; o cloro não é um bom grupo abandonador porque forma uma base instável.
Sn2 e Sn2; o cloro é um bom grupo abandonador, pois forma uma base estável.
Os ácidos carboxílicos são compostos orgânicos que apresentam o mais pronunciado caráter ácido, muito embora sejam considerados ácidos fracos. Quando em solução aquosa, liberam íon hidrônio ou hidroxônio, como a reação a seguir:
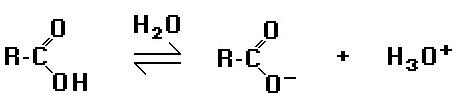 Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Propanóico.
Monocloro acético.
γ-iodo pentanóico.
Benzóico.
β-cloro butanóico.
O principal grupo funcional representante da basicidade dos compostos orgânicos são as aminas, que são compostos derivados da amônia (NH3) por substituição de um ou mais hidrogênios por radicais orgânicos. Com relação às aminas, analise as afirmações abaixo e assinale a alternativa que apresenta as afirmativas corretas.
I) O caráter básico destes compostos é consequência da existência de um par desemparelhado de elétrons sobre o átomo de nitrogênio.
II) a amina aromática mais simples denomina-se fenilamina ou anilina.
III) A benzilamina é uma amina isômera da metilfenilamina.
IV) Todas as aminas têm a propriedade de associar suas moléculas, formando pontes de hidrogênio.
V) A etilamina pode ser obtida pela reação de redução do cianeto de metila.
II, III, IV e V
I, II, IV e V
I, II, III e IV
I, II, III e V
Todas são corretas
A química consegue, através de diversas reações, transformar o benzeno em muitos outros compostos e esses adquirem propriedades diferentes do benzeno graças as ligações pi (π), tendo então uma grande aplicação em nosso dia-a-dia. Sabendo disso, responda qual o número de ligações pi (π) no produto formado da síntese do AAS?

5
8
6
11
3
Vários grupamentos podem ser adicionados ao grupo carbonila por meio de reação de adição. Um dos grupos importantes de entrada no grupo carbonila é o cianeto (CN-). Escolha a alternativa correta em relação a esse íon.
O íon cianeto não é encontrado livre de seu cátion em soluções de cianeto de sódio preparadas para uso de laboratório.
Numa reação de adição o íon cianeto ataca o carbono nucleofilico do grupo carbonila, pois o íon cianeto é eletroílico.
O produto de uma reação com o íon cianeto é chamado de nitrila.
Borbulhar em água o gás cianídrico ou dissolver o sal cianeto de sódio em água.
O íon cianeto é considerado bastante eletrofílico.
Ésteres são compostos derivados de ácidos carboxílicos formados pela reação entre um álcool e um ácido carboxílico. Os ésteres de baixo peso molecular normalmente têm cheiro agradável. Podemos citar, como exemplo, as essências de abacaxi, framboesa e laranja. Um dos resultados obtidos com relação à essência de abacaxi, após a reação de um álcool e um ácido carboxílico, é:
 Analisando a reação acima, podemos afirmar que o álcool e o ácido carboxílico que a resultam são:
Analisando a reação acima, podemos afirmar que o álcool e o ácido carboxílico que a resultam são:
Ácido butanóico e etanol.
Ácido propanóico e metanol.
Ácido metanóico e butanol.
Ácido pentanóico e etanol.
Ácido butanóico e propanol.
Os compostos carbonilados podem ser atacados por um nucleófilo formando um intermediário tetraédrico como mostrado no esquema da reação abaixo. Com relação ao mecanismo proposto podemos afirmar que:

A base mais forte é preferencialmente eliminada por ser mais estável.
Se o grupo Z- for uma base mais fraca que Y, o intermediário tetraédrico irá preferencialmente eliminar o grupo Z e restaurar o reagente.
Os grupos Y- e Z- tiverem basicidade similares não ocorre eliminação de nenhum desses grupos.
O carbono da carbonila é um nucleófilo e podemos prever que será atacado por um eletrófilo.
O carbono da carbonila no reagente tem hibridação sp3 e o intermediário tetraédrico sp2.
As reações abaixo podem ocorrer através de substituições nucleofílicas do tipo Sn1 ou Sn2. A reação de substituição classificada como Sn1 ocorre via formação de carbocátion, e a Sn2, o nucleófilo faz o ataque por trás do grupo abandonador formando um produto com configuração invertida. Considerando os conceitos de substituição nucleofílica, com relação à classificação das reações 1 e 2 abaixo e a natureza do grupo abandonador cloro, pode-se afirmar que:

Sn1 e Sn2; o cloro é um bom grupo abandonador, pois forma uma base estável.
Sn1 e Sn1; o cloro sai na forma de Cl- e pode ser considerado uma base forte.
Sn2 e Sn1; o cloro sai na forma de Cl- pelo fato de ser uma base fraca.
Sn1 e Sn2; o cloro não é um bom grupo abandonador porque forma uma base instável.
Sn2 e Sn2; o cloro é um bom grupo abandonador, pois forma uma base estável.
Os ácidos carboxílicos são compostos orgânicos que apresentam o mais pronunciado caráter ácido, muito embora sejam considerados ácidos fracos. Quando em solução aquosa, liberam íon hidrônio ou hidroxônio, como a reação a seguir:
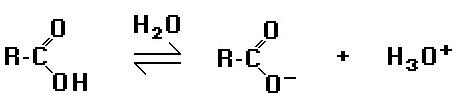 Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Propanóico.
Monocloro acético.
γ-iodo pentanóico.
Benzóico.
β-cloro butanóico.
O principal grupo funcional representante da basicidade dos compostos orgânicos são as aminas, que são compostos derivados da amônia (NH3) por substituição de um ou mais hidrogênios por radicais orgânicos. Com relação às aminas, analise as afirmações abaixo e assinale a alternativa que apresenta as afirmativas corretas.
I) O caráter básico destes compostos é consequência da existência de um par desemparelhado de elétrons sobre o átomo de nitrogênio.
II) a amina aromática mais simples denomina-se fenilamina ou anilina.
III) A benzilamina é uma amina isômera da metilfenilamina.
IV) Todas as aminas têm a propriedade de associar suas moléculas, formando pontes de hidrogênio.
V) A etilamina pode ser obtida pela reação de redução do cianeto de metila.
II, III, IV e V
I, II, IV e V
I, II, III e IV
I, II, III e V
Todas são corretas
A química consegue, através de diversas reações, transformar o benzeno em muitos outros compostos e esses adquirem propriedades diferentes do benzeno graças as ligações pi (π), tendo então uma grande aplicação em nosso dia-a-dia. Sabendo disso, responda qual o número de ligações pi (π) no produto formado da síntese do AAS?

O íon cianeto não é encontrado livre de seu cátion em soluções de cianeto de sódio preparadas para uso de laboratório.
Numa reação de adição o íon cianeto ataca o carbono nucleofilico do grupo carbonila, pois o íon cianeto é eletroílico.
O produto de uma reação com o íon cianeto é chamado de nitrila.
Borbulhar em água o gás cianídrico ou dissolver o sal cianeto de sódio em água.
O íon cianeto é considerado bastante eletrofílico.
Ésteres são compostos derivados de ácidos carboxílicos formados pela reação entre um álcool e um ácido carboxílico. Os ésteres de baixo peso molecular normalmente têm cheiro agradável. Podemos citar, como exemplo, as essências de abacaxi, framboesa e laranja. Um dos resultados obtidos com relação à essência de abacaxi, após a reação de um álcool e um ácido carboxílico, é:
 Analisando a reação acima, podemos afirmar que o álcool e o ácido carboxílico que a resultam são:
Analisando a reação acima, podemos afirmar que o álcool e o ácido carboxílico que a resultam são:
Ácido butanóico e etanol.
Ácido propanóico e metanol.
Ácido metanóico e butanol.
Ácido pentanóico e etanol.
Ácido butanóico e propanol.
Os compostos carbonilados podem ser atacados por um nucleófilo formando um intermediário tetraédrico como mostrado no esquema da reação abaixo. Com relação ao mecanismo proposto podemos afirmar que:

A base mais forte é preferencialmente eliminada por ser mais estável.
Se o grupo Z- for uma base mais fraca que Y, o intermediário tetraédrico irá preferencialmente eliminar o grupo Z e restaurar o reagente.
Os grupos Y- e Z- tiverem basicidade similares não ocorre eliminação de nenhum desses grupos.
O carbono da carbonila é um nucleófilo e podemos prever que será atacado por um eletrófilo.
O carbono da carbonila no reagente tem hibridação sp3 e o intermediário tetraédrico sp2.
As reações abaixo podem ocorrer através de substituições nucleofílicas do tipo Sn1 ou Sn2. A reação de substituição classificada como Sn1 ocorre via formação de carbocátion, e a Sn2, o nucleófilo faz o ataque por trás do grupo abandonador formando um produto com configuração invertida. Considerando os conceitos de substituição nucleofílica, com relação à classificação das reações 1 e 2 abaixo e a natureza do grupo abandonador cloro, pode-se afirmar que:

Sn1 e Sn2; o cloro é um bom grupo abandonador, pois forma uma base estável.
Sn1 e Sn1; o cloro sai na forma de Cl- e pode ser considerado uma base forte.
Sn2 e Sn1; o cloro sai na forma de Cl- pelo fato de ser uma base fraca.
Sn1 e Sn2; o cloro não é um bom grupo abandonador porque forma uma base instável.
Sn2 e Sn2; o cloro é um bom grupo abandonador, pois forma uma base estável.
Os ácidos carboxílicos são compostos orgânicos que apresentam o mais pronunciado caráter ácido, muito embora sejam considerados ácidos fracos. Quando em solução aquosa, liberam íon hidrônio ou hidroxônio, como a reação a seguir:
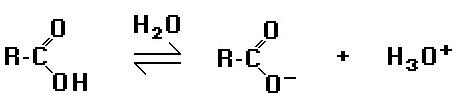 Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Propanóico.
Monocloro acético.
γ-iodo pentanóico.
Benzóico.
β-cloro butanóico.
O principal grupo funcional representante da basicidade dos compostos orgânicos são as aminas, que são compostos derivados da amônia (NH3) por substituição de um ou mais hidrogênios por radicais orgânicos. Com relação às aminas, analise as afirmações abaixo e assinale a alternativa que apresenta as afirmativas corretas.
I) O caráter básico destes compostos é consequência da existência de um par desemparelhado de elétrons sobre o átomo de nitrogênio.
II) a amina aromática mais simples denomina-se fenilamina ou anilina.
III) A benzilamina é uma amina isômera da metilfenilamina.
IV) Todas as aminas têm a propriedade de associar suas moléculas, formando pontes de hidrogênio.
V) A etilamina pode ser obtida pela reação de redução do cianeto de metila.
II, III, IV e V
I, II, IV e V
I, II, III e IV
I, II, III e V
Todas são corretas
A química consegue, através de diversas reações, transformar o benzeno em muitos outros compostos e esses adquirem propriedades diferentes do benzeno graças as ligações pi (π), tendo então uma grande aplicação em nosso dia-a-dia. Sabendo disso, responda qual o número de ligações pi (π) no produto formado da síntese do AAS?

Ácido butanóico e etanol.
Ácido propanóico e metanol.
Ácido metanóico e butanol.
Ácido pentanóico e etanol.
Ácido butanóico e propanol.
Os compostos carbonilados podem ser atacados por um nucleófilo formando um intermediário tetraédrico como mostrado no esquema da reação abaixo. Com relação ao mecanismo proposto podemos afirmar que:

A base mais forte é preferencialmente eliminada por ser mais estável.
Se o grupo Z- for uma base mais fraca que Y, o intermediário tetraédrico irá preferencialmente eliminar o grupo Z e restaurar o reagente.
Os grupos Y- e Z- tiverem basicidade similares não ocorre eliminação de nenhum desses grupos.
O carbono da carbonila é um nucleófilo e podemos prever que será atacado por um eletrófilo.
O carbono da carbonila no reagente tem hibridação sp3 e o intermediário tetraédrico sp2.
As reações abaixo podem ocorrer através de substituições nucleofílicas do tipo Sn1 ou Sn2. A reação de substituição classificada como Sn1 ocorre via formação de carbocátion, e a Sn2, o nucleófilo faz o ataque por trás do grupo abandonador formando um produto com configuração invertida. Considerando os conceitos de substituição nucleofílica, com relação à classificação das reações 1 e 2 abaixo e a natureza do grupo abandonador cloro, pode-se afirmar que:

Sn1 e Sn2; o cloro é um bom grupo abandonador, pois forma uma base estável.
Sn1 e Sn1; o cloro sai na forma de Cl- e pode ser considerado uma base forte.
Sn2 e Sn1; o cloro sai na forma de Cl- pelo fato de ser uma base fraca.
Sn1 e Sn2; o cloro não é um bom grupo abandonador porque forma uma base instável.
Sn2 e Sn2; o cloro é um bom grupo abandonador, pois forma uma base estável.
Os ácidos carboxílicos são compostos orgânicos que apresentam o mais pronunciado caráter ácido, muito embora sejam considerados ácidos fracos. Quando em solução aquosa, liberam íon hidrônio ou hidroxônio, como a reação a seguir:
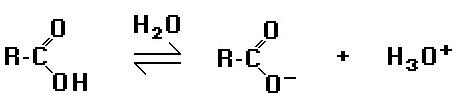 Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Propanóico.
Monocloro acético.
γ-iodo pentanóico.
Benzóico.
β-cloro butanóico.
O principal grupo funcional representante da basicidade dos compostos orgânicos são as aminas, que são compostos derivados da amônia (NH3) por substituição de um ou mais hidrogênios por radicais orgânicos. Com relação às aminas, analise as afirmações abaixo e assinale a alternativa que apresenta as afirmativas corretas.
I) O caráter básico destes compostos é consequência da existência de um par desemparelhado de elétrons sobre o átomo de nitrogênio.
II) a amina aromática mais simples denomina-se fenilamina ou anilina.
III) A benzilamina é uma amina isômera da metilfenilamina.
IV) Todas as aminas têm a propriedade de associar suas moléculas, formando pontes de hidrogênio.
V) A etilamina pode ser obtida pela reação de redução do cianeto de metila.
II, III, IV e V
I, II, IV e V
I, II, III e IV
I, II, III e V
Todas são corretas
A química consegue, através de diversas reações, transformar o benzeno em muitos outros compostos e esses adquirem propriedades diferentes do benzeno graças as ligações pi (π), tendo então uma grande aplicação em nosso dia-a-dia. Sabendo disso, responda qual o número de ligações pi (π) no produto formado da síntese do AAS?


A base mais forte é preferencialmente eliminada por ser mais estável.
Se o grupo Z- for uma base mais fraca que Y, o intermediário tetraédrico irá preferencialmente eliminar o grupo Z e restaurar o reagente.
Os grupos Y- e Z- tiverem basicidade similares não ocorre eliminação de nenhum desses grupos.
O carbono da carbonila é um nucleófilo e podemos prever que será atacado por um eletrófilo.
O carbono da carbonila no reagente tem hibridação sp3 e o intermediário tetraédrico sp2.
As reações abaixo podem ocorrer através de substituições nucleofílicas do tipo Sn1 ou Sn2. A reação de substituição classificada como Sn1 ocorre via formação de carbocátion, e a Sn2, o nucleófilo faz o ataque por trás do grupo abandonador formando um produto com configuração invertida. Considerando os conceitos de substituição nucleofílica, com relação à classificação das reações 1 e 2 abaixo e a natureza do grupo abandonador cloro, pode-se afirmar que:

Sn1 e Sn2; o cloro é um bom grupo abandonador, pois forma uma base estável.
Sn1 e Sn1; o cloro sai na forma de Cl- e pode ser considerado uma base forte.
Sn2 e Sn1; o cloro sai na forma de Cl- pelo fato de ser uma base fraca.
Sn1 e Sn2; o cloro não é um bom grupo abandonador porque forma uma base instável.
Sn2 e Sn2; o cloro é um bom grupo abandonador, pois forma uma base estável.
Os ácidos carboxílicos são compostos orgânicos que apresentam o mais pronunciado caráter ácido, muito embora sejam considerados ácidos fracos. Quando em solução aquosa, liberam íon hidrônio ou hidroxônio, como a reação a seguir:
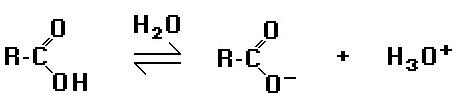 Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Propanóico.
Monocloro acético.
γ-iodo pentanóico.
Benzóico.
β-cloro butanóico.
O principal grupo funcional representante da basicidade dos compostos orgânicos são as aminas, que são compostos derivados da amônia (NH3) por substituição de um ou mais hidrogênios por radicais orgânicos. Com relação às aminas, analise as afirmações abaixo e assinale a alternativa que apresenta as afirmativas corretas.
I) O caráter básico destes compostos é consequência da existência de um par desemparelhado de elétrons sobre o átomo de nitrogênio.
II) a amina aromática mais simples denomina-se fenilamina ou anilina.
III) A benzilamina é uma amina isômera da metilfenilamina.
IV) Todas as aminas têm a propriedade de associar suas moléculas, formando pontes de hidrogênio.
V) A etilamina pode ser obtida pela reação de redução do cianeto de metila.
II, III, IV e V
I, II, IV e V
I, II, III e IV
I, II, III e V
Todas são corretas
A química consegue, através de diversas reações, transformar o benzeno em muitos outros compostos e esses adquirem propriedades diferentes do benzeno graças as ligações pi (π), tendo então uma grande aplicação em nosso dia-a-dia. Sabendo disso, responda qual o número de ligações pi (π) no produto formado da síntese do AAS?


Sn1 e Sn2; o cloro é um bom grupo abandonador, pois forma uma base estável.
Sn1 e Sn1; o cloro sai na forma de Cl- e pode ser considerado uma base forte.
Sn2 e Sn1; o cloro sai na forma de Cl- pelo fato de ser uma base fraca.
Sn1 e Sn2; o cloro não é um bom grupo abandonador porque forma uma base instável.
Sn2 e Sn2; o cloro é um bom grupo abandonador, pois forma uma base estável.
Os ácidos carboxílicos são compostos orgânicos que apresentam o mais pronunciado caráter ácido, muito embora sejam considerados ácidos fracos. Quando em solução aquosa, liberam íon hidrônio ou hidroxônio, como a reação a seguir:
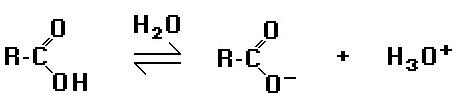 Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Propanóico.
Monocloro acético.
γ-iodo pentanóico.
Benzóico.
β-cloro butanóico.
O principal grupo funcional representante da basicidade dos compostos orgânicos são as aminas, que são compostos derivados da amônia (NH3) por substituição de um ou mais hidrogênios por radicais orgânicos. Com relação às aminas, analise as afirmações abaixo e assinale a alternativa que apresenta as afirmativas corretas.
I) O caráter básico destes compostos é consequência da existência de um par desemparelhado de elétrons sobre o átomo de nitrogênio.
II) a amina aromática mais simples denomina-se fenilamina ou anilina.
III) A benzilamina é uma amina isômera da metilfenilamina.
IV) Todas as aminas têm a propriedade de associar suas moléculas, formando pontes de hidrogênio.
V) A etilamina pode ser obtida pela reação de redução do cianeto de metila.
II, III, IV e V
I, II, IV e V
I, II, III e IV
I, II, III e V
Todas são corretas
A química consegue, através de diversas reações, transformar o benzeno em muitos outros compostos e esses adquirem propriedades diferentes do benzeno graças as ligações pi (π), tendo então uma grande aplicação em nosso dia-a-dia. Sabendo disso, responda qual o número de ligações pi (π) no produto formado da síntese do AAS?

Propanóico.
Monocloro acético.
γ-iodo pentanóico.
Benzóico.
β-cloro butanóico.
O principal grupo funcional representante da basicidade dos compostos orgânicos são as aminas, que são compostos derivados da amônia (NH3) por substituição de um ou mais hidrogênios por radicais orgânicos. Com relação às aminas, analise as afirmações abaixo e assinale a alternativa que apresenta as afirmativas corretas.
I) O caráter básico destes compostos é consequência da existência de um par desemparelhado de elétrons sobre o átomo de nitrogênio.
II) a amina aromática mais simples denomina-se fenilamina ou anilina.
III) A benzilamina é uma amina isômera da metilfenilamina.
IV) Todas as aminas têm a propriedade de associar suas moléculas, formando pontes de hidrogênio.
V) A etilamina pode ser obtida pela reação de redução do cianeto de metila.
II, III, IV e V
I, II, IV e V
I, II, III e IV
I, II, III e V
Todas são corretas
A química consegue, através de diversas reações, transformar o benzeno em muitos outros compostos e esses adquirem propriedades diferentes do benzeno graças as ligações pi (π), tendo então uma grande aplicação em nosso dia-a-dia. Sabendo disso, responda qual o número de ligações pi (π) no produto formado da síntese do AAS?

II, III, IV e V
I, II, IV e V
I, II, III e IV
I, II, III e V
Todas são corretas
A química consegue, através de diversas reações, transformar o benzeno em muitos outros compostos e esses adquirem propriedades diferentes do benzeno graças as ligações pi (π), tendo então uma grande aplicação em nosso dia-a-dia. Sabendo disso, responda qual o número de ligações pi (π) no produto formado da síntese do AAS?

