QUÍMICA ORGÂNICA III
Os álcoois podem ser classificados em primários, secundários e terciários. De acordo com essa classificação é possível prever qual será o produto principal formado diante de reações de oxidação. A combustão, ou seja, a queima que ocorre com o etanol nos automóveis, pode ser considerada também uma reação de oxidação. Dentre os produtos formados na oxidação do etanol nos automóveis estão os aldeídos, isso se deve a:
fragmentação da molécula do álcool.
oxidação completa do álcool.
redução do álcool.
oxidação parcial do álcool.
reação do álcool com o nitrogênio do ar.
Os álcoois podem sofrer reações de oxidação com KMnO4 em meio ácido ou com K2Cr2O7 em meio ácido, com relação aos produtos de oxidação, qual dos álcoois abaixo que pode gerar a partir da sua oxidação a propanona:
etanol
etanal
propan-1-ol
propan-2-ol
propanal
Um álcool primário, como o etanol, pode ser obtido pela redução de um ácido carboxílico. Assinale a alternativa CORRETA para o agente redutor que pode ser utilizado nesta reação.
LiAlH4
K2CrO4
H2SO4 concentrado
K2Cr2O7
HNO3 concentrado
O aspartame, utilizado como adoçante, corresponde a apenas um dos estereoisômeros da molécula cuja fórmula estrutural é apresentada abaixo.
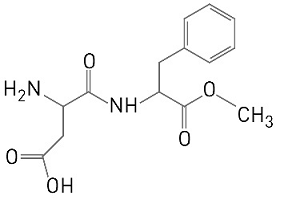 Admita que, em um processo industrial, tenha-se obtido a mistura, em partes iguais, de todos os estereoisômeros dessa molécula. Nessa mistura, o percentual de aspartame equivale a:
Admita que, em um processo industrial, tenha-se obtido a mistura, em partes iguais, de todos os estereoisômeros dessa molécula. Nessa mistura, o percentual de aspartame equivale a:
75%
33%
25%
50%
20%
O ácido oleico, cuja estrutura química está representada abaixo, forma-se durante a decomposição de formigas mortas, sendo um sinal químico para que as outras formigas as retirem do ninho.
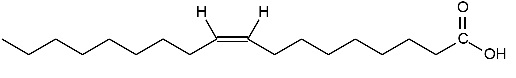
Analise a veracidade (V) ou falsidade (F) das proposições abaixo, sobre o ácido oleico.
( ) De acordo com a nomenclatura IUPAC, ele é denominado ácido cis-octadec-9-enoico.
( ) Ele possui dois átomos de carbono primário e quatorze átomos de carbono secundário.
( ) Ele apresenta cadeia aberta, normal, insaturada e heterogênea.
Assinale a alternativa que preenche corretamente os parênteses, de cima para baixo.
F – F – F
V – V – F
V – F – F
F – V – V
V – F – V
O cloranfenicol é uma substância que tem propriedade antibacteriana e por isso é utilizado como antibiótico em seres humanos e animais.
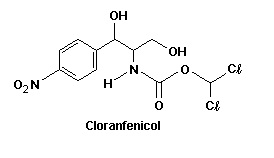 Com relação à estrutura do cloranfenicol, considere as seguintes afirmativas:
Com relação à estrutura do cloranfenicol, considere as seguintes afirmativas:
1. A substância apresenta um grupo amino ligado ao anel aromático.
2. Existe um grupamento álcool em carbono terciário na estrutura.
3. Esse composto apresenta dois átomos de carbono assimétricos (quirais).
4. A molécula apresenta o grupo funcional cetona.
5. O anel aromático presente na estrutura é para-dissubstituído.
Assinale a alternativa correta:
Somente as afirmativas 3 e 5 são verdadeiras.
Somente as afirmativas 1 e 2 são verdadeiras.
Somente as afirmativas 1, 2 e 3 são verdadeiras.
Somente as afirmativas 4 e 5 são verdadeiras.
Somente a afirmativa 4 é verdadeira.
Os grupos orientadores ligados ao anel aromático podem ser classificados como ativantes (orto para dirigentes) ou desativantes (meta dirigentes). Qual alternativa a seguir, contém apenas grupos meta dirigentes?
– NO2, – Cl, – Br
– CHO, – NH2, – CH3
– SO3H, – NO2, – COOH
– CH3, – Cl, – NH2
– CH3, – NO2, – COOH
Os álcoois podem ser classificados em primários, secundários e terciários. De acordo com essa classificação é possível prever qual será o produto principal formado diante de reações de oxidação. A combustão, ou seja, a queima que ocorre com o etanol nos automóveis, pode ser considerada também uma reação de oxidação. Dentre os produtos formados na oxidação do etanol nos automóveis estão os aldeídos, isso se deve a:
fragmentação da molécula do álcool.
oxidação parcial do álcool.
reação do álcool com o nitrogênio do ar.
oxidação completa do álcool.
redução do álcool.
As fórmulas estruturais de alguns componentes de óleos essenciais, responsáveis pelo aroma de certas ervas e flores, são:
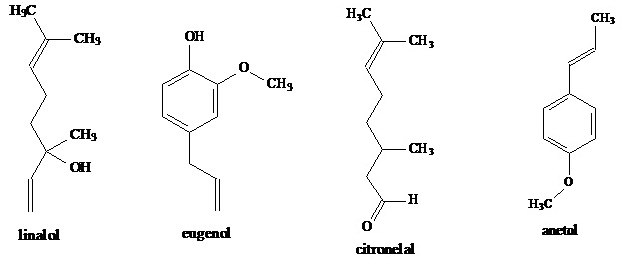 Dentre esses compostos, são isômeros:
Dentre esses compostos, são isômeros:
anetol e linalol.
linalol e citronelal.
eugenol e linalol.
citronelal e eugenol.
eugenol e anetol.
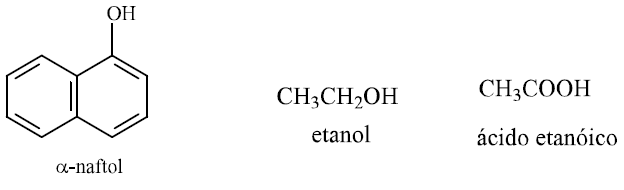
Analise as estruturas químicas: α-naftol, etanol e ácido etanóico, e através de suas funções orgânicas é possível classifique-as respectivamente em:
fragmentação da molécula do álcool.
oxidação completa do álcool.
redução do álcool.
oxidação parcial do álcool.
reação do álcool com o nitrogênio do ar.
Os álcoois podem sofrer reações de oxidação com KMnO4 em meio ácido ou com K2Cr2O7 em meio ácido, com relação aos produtos de oxidação, qual dos álcoois abaixo que pode gerar a partir da sua oxidação a propanona:
etanol
etanal
propan-1-ol
propan-2-ol
propanal
Um álcool primário, como o etanol, pode ser obtido pela redução de um ácido carboxílico. Assinale a alternativa CORRETA para o agente redutor que pode ser utilizado nesta reação.
LiAlH4
K2CrO4
H2SO4 concentrado
K2Cr2O7
HNO3 concentrado
O aspartame, utilizado como adoçante, corresponde a apenas um dos estereoisômeros da molécula cuja fórmula estrutural é apresentada abaixo.
 Admita que, em um processo industrial, tenha-se obtido a mistura, em partes iguais, de todos os estereoisômeros dessa molécula. Nessa mistura, o percentual de aspartame equivale a:
Admita que, em um processo industrial, tenha-se obtido a mistura, em partes iguais, de todos os estereoisômeros dessa molécula. Nessa mistura, o percentual de aspartame equivale a:
75%
33%
25%
50%
20%
O ácido oleico, cuja estrutura química está representada abaixo, forma-se durante a decomposição de formigas mortas, sendo um sinal químico para que as outras formigas as retirem do ninho.

Analise a veracidade (V) ou falsidade (F) das proposições abaixo, sobre o ácido oleico.
( ) De acordo com a nomenclatura IUPAC, ele é denominado ácido cis-octadec-9-enoico.
( ) Ele possui dois átomos de carbono primário e quatorze átomos de carbono secundário.
( ) Ele apresenta cadeia aberta, normal, insaturada e heterogênea.
Assinale a alternativa que preenche corretamente os parênteses, de cima para baixo.
F – F – F
V – V – F
V – F – F
F – V – V
V – F – V
O cloranfenicol é uma substância que tem propriedade antibacteriana e por isso é utilizado como antibiótico em seres humanos e animais.
 Com relação à estrutura do cloranfenicol, considere as seguintes afirmativas:
Com relação à estrutura do cloranfenicol, considere as seguintes afirmativas:
1. A substância apresenta um grupo amino ligado ao anel aromático.
2. Existe um grupamento álcool em carbono terciário na estrutura.
3. Esse composto apresenta dois átomos de carbono assimétricos (quirais).
4. A molécula apresenta o grupo funcional cetona.
5. O anel aromático presente na estrutura é para-dissubstituído.
Assinale a alternativa correta:
Somente as afirmativas 3 e 5 são verdadeiras.
Somente as afirmativas 1 e 2 são verdadeiras.
Somente as afirmativas 1, 2 e 3 são verdadeiras.
Somente as afirmativas 4 e 5 são verdadeiras.
Somente a afirmativa 4 é verdadeira.
Os grupos orientadores ligados ao anel aromático podem ser classificados como ativantes (orto para dirigentes) ou desativantes (meta dirigentes). Qual alternativa a seguir, contém apenas grupos meta dirigentes?
– NO2, – Cl, – Br
– CHO, – NH2, – CH3
– SO3H, – NO2, – COOH
– CH3, – Cl, – NH2
– CH3, – NO2, – COOH
Os álcoois podem ser classificados em primários, secundários e terciários. De acordo com essa classificação é possível prever qual será o produto principal formado diante de reações de oxidação. A combustão, ou seja, a queima que ocorre com o etanol nos automóveis, pode ser considerada também uma reação de oxidação. Dentre os produtos formados na oxidação do etanol nos automóveis estão os aldeídos, isso se deve a:
fragmentação da molécula do álcool.
oxidação parcial do álcool.
reação do álcool com o nitrogênio do ar.
oxidação completa do álcool.
redução do álcool.
As fórmulas estruturais de alguns componentes de óleos essenciais, responsáveis pelo aroma de certas ervas e flores, são:
 Dentre esses compostos, são isômeros:
Dentre esses compostos, são isômeros:
anetol e linalol.
linalol e citronelal.
eugenol e linalol.
citronelal e eugenol.
eugenol e anetol.
Analise as estruturas químicas: α-naftol, etanol e ácido etanóico, e através de suas funções orgânicas é possível classifique-as respectivamente em:

etanol
etanal
propan-1-ol
propan-2-ol
propanal
Um álcool primário, como o etanol, pode ser obtido pela redução de um ácido carboxílico. Assinale a alternativa CORRETA para o agente redutor que pode ser utilizado nesta reação.
LiAlH4
K2CrO4
H2SO4 concentrado
K2Cr2O7
HNO3 concentrado
O aspartame, utilizado como adoçante, corresponde a apenas um dos estereoisômeros da molécula cuja fórmula estrutural é apresentada abaixo.
 Admita que, em um processo industrial, tenha-se obtido a mistura, em partes iguais, de todos os estereoisômeros dessa molécula. Nessa mistura, o percentual de aspartame equivale a:
Admita que, em um processo industrial, tenha-se obtido a mistura, em partes iguais, de todos os estereoisômeros dessa molécula. Nessa mistura, o percentual de aspartame equivale a:
75%
33%
25%
50%
20%
O ácido oleico, cuja estrutura química está representada abaixo, forma-se durante a decomposição de formigas mortas, sendo um sinal químico para que as outras formigas as retirem do ninho.

Analise a veracidade (V) ou falsidade (F) das proposições abaixo, sobre o ácido oleico.
( ) De acordo com a nomenclatura IUPAC, ele é denominado ácido cis-octadec-9-enoico.
( ) Ele possui dois átomos de carbono primário e quatorze átomos de carbono secundário.
( ) Ele apresenta cadeia aberta, normal, insaturada e heterogênea.
Assinale a alternativa que preenche corretamente os parênteses, de cima para baixo.
F – F – F
V – V – F
V – F – F
F – V – V
V – F – V
O cloranfenicol é uma substância que tem propriedade antibacteriana e por isso é utilizado como antibiótico em seres humanos e animais.
 Com relação à estrutura do cloranfenicol, considere as seguintes afirmativas:
Com relação à estrutura do cloranfenicol, considere as seguintes afirmativas:
1. A substância apresenta um grupo amino ligado ao anel aromático.
2. Existe um grupamento álcool em carbono terciário na estrutura.
3. Esse composto apresenta dois átomos de carbono assimétricos (quirais).
4. A molécula apresenta o grupo funcional cetona.
5. O anel aromático presente na estrutura é para-dissubstituído.
Assinale a alternativa correta:
Somente as afirmativas 3 e 5 são verdadeiras.
Somente as afirmativas 1 e 2 são verdadeiras.
Somente as afirmativas 1, 2 e 3 são verdadeiras.
Somente as afirmativas 4 e 5 são verdadeiras.
Somente a afirmativa 4 é verdadeira.
Os grupos orientadores ligados ao anel aromático podem ser classificados como ativantes (orto para dirigentes) ou desativantes (meta dirigentes). Qual alternativa a seguir, contém apenas grupos meta dirigentes?
– NO2, – Cl, – Br
– CHO, – NH2, – CH3
– SO3H, – NO2, – COOH
– CH3, – Cl, – NH2
– CH3, – NO2, – COOH
Os álcoois podem ser classificados em primários, secundários e terciários. De acordo com essa classificação é possível prever qual será o produto principal formado diante de reações de oxidação. A combustão, ou seja, a queima que ocorre com o etanol nos automóveis, pode ser considerada também uma reação de oxidação. Dentre os produtos formados na oxidação do etanol nos automóveis estão os aldeídos, isso se deve a:
fragmentação da molécula do álcool.
oxidação parcial do álcool.
reação do álcool com o nitrogênio do ar.
oxidação completa do álcool.
redução do álcool.
As fórmulas estruturais de alguns componentes de óleos essenciais, responsáveis pelo aroma de certas ervas e flores, são:
 Dentre esses compostos, são isômeros:
Dentre esses compostos, são isômeros:
anetol e linalol.
linalol e citronelal.
eugenol e linalol.
citronelal e eugenol.
eugenol e anetol.
Analise as estruturas químicas: α-naftol, etanol e ácido etanóico, e através de suas funções orgânicas é possível classifique-as respectivamente em:

LiAlH4
K2CrO4
H2SO4 concentrado
K2Cr2O7
HNO3 concentrado
O aspartame, utilizado como adoçante, corresponde a apenas um dos estereoisômeros da molécula cuja fórmula estrutural é apresentada abaixo.
 Admita que, em um processo industrial, tenha-se obtido a mistura, em partes iguais, de todos os estereoisômeros dessa molécula. Nessa mistura, o percentual de aspartame equivale a:
Admita que, em um processo industrial, tenha-se obtido a mistura, em partes iguais, de todos os estereoisômeros dessa molécula. Nessa mistura, o percentual de aspartame equivale a:
75%
33%
25%
50%
20%
O ácido oleico, cuja estrutura química está representada abaixo, forma-se durante a decomposição de formigas mortas, sendo um sinal químico para que as outras formigas as retirem do ninho.

Analise a veracidade (V) ou falsidade (F) das proposições abaixo, sobre o ácido oleico.
( ) De acordo com a nomenclatura IUPAC, ele é denominado ácido cis-octadec-9-enoico.
( ) Ele possui dois átomos de carbono primário e quatorze átomos de carbono secundário.
( ) Ele apresenta cadeia aberta, normal, insaturada e heterogênea.
Assinale a alternativa que preenche corretamente os parênteses, de cima para baixo.
F – F – F
V – V – F
V – F – F
F – V – V
V – F – V
O cloranfenicol é uma substância que tem propriedade antibacteriana e por isso é utilizado como antibiótico em seres humanos e animais.
 Com relação à estrutura do cloranfenicol, considere as seguintes afirmativas:
Com relação à estrutura do cloranfenicol, considere as seguintes afirmativas:
1. A substância apresenta um grupo amino ligado ao anel aromático.
2. Existe um grupamento álcool em carbono terciário na estrutura.
3. Esse composto apresenta dois átomos de carbono assimétricos (quirais).
4. A molécula apresenta o grupo funcional cetona.
5. O anel aromático presente na estrutura é para-dissubstituído.
Assinale a alternativa correta:
Somente as afirmativas 3 e 5 são verdadeiras.
Somente as afirmativas 1 e 2 são verdadeiras.
Somente as afirmativas 1, 2 e 3 são verdadeiras.
Somente as afirmativas 4 e 5 são verdadeiras.
Somente a afirmativa 4 é verdadeira.
Os grupos orientadores ligados ao anel aromático podem ser classificados como ativantes (orto para dirigentes) ou desativantes (meta dirigentes). Qual alternativa a seguir, contém apenas grupos meta dirigentes?
– NO2, – Cl, – Br
– CHO, – NH2, – CH3
– SO3H, – NO2, – COOH
– CH3, – Cl, – NH2
– CH3, – NO2, – COOH
Os álcoois podem ser classificados em primários, secundários e terciários. De acordo com essa classificação é possível prever qual será o produto principal formado diante de reações de oxidação. A combustão, ou seja, a queima que ocorre com o etanol nos automóveis, pode ser considerada também uma reação de oxidação. Dentre os produtos formados na oxidação do etanol nos automóveis estão os aldeídos, isso se deve a:
fragmentação da molécula do álcool.
oxidação parcial do álcool.
reação do álcool com o nitrogênio do ar.
oxidação completa do álcool.
redução do álcool.
As fórmulas estruturais de alguns componentes de óleos essenciais, responsáveis pelo aroma de certas ervas e flores, são:
 Dentre esses compostos, são isômeros:
Dentre esses compostos, são isômeros:
anetol e linalol.
linalol e citronelal.
eugenol e linalol.
citronelal e eugenol.
eugenol e anetol.
Analise as estruturas químicas: α-naftol, etanol e ácido etanóico, e através de suas funções orgânicas é possível classifique-as respectivamente em:

75%
33%
25%
50%
20%
O ácido oleico, cuja estrutura química está representada abaixo, forma-se durante a decomposição de formigas mortas, sendo um sinal químico para que as outras formigas as retirem do ninho.

Analise a veracidade (V) ou falsidade (F) das proposições abaixo, sobre o ácido oleico.
( ) De acordo com a nomenclatura IUPAC, ele é denominado ácido cis-octadec-9-enoico.
( ) Ele possui dois átomos de carbono primário e quatorze átomos de carbono secundário.
( ) Ele apresenta cadeia aberta, normal, insaturada e heterogênea.
Assinale a alternativa que preenche corretamente os parênteses, de cima para baixo.
F – F – F
V – V – F
V – F – F
F – V – V
V – F – V
O cloranfenicol é uma substância que tem propriedade antibacteriana e por isso é utilizado como antibiótico em seres humanos e animais.
 Com relação à estrutura do cloranfenicol, considere as seguintes afirmativas:
Com relação à estrutura do cloranfenicol, considere as seguintes afirmativas:
1. A substância apresenta um grupo amino ligado ao anel aromático.
2. Existe um grupamento álcool em carbono terciário na estrutura.
3. Esse composto apresenta dois átomos de carbono assimétricos (quirais).
4. A molécula apresenta o grupo funcional cetona.
5. O anel aromático presente na estrutura é para-dissubstituído.
Assinale a alternativa correta:
Somente as afirmativas 3 e 5 são verdadeiras.
Somente as afirmativas 1 e 2 são verdadeiras.
Somente as afirmativas 1, 2 e 3 são verdadeiras.
Somente as afirmativas 4 e 5 são verdadeiras.
Somente a afirmativa 4 é verdadeira.
Os grupos orientadores ligados ao anel aromático podem ser classificados como ativantes (orto para dirigentes) ou desativantes (meta dirigentes). Qual alternativa a seguir, contém apenas grupos meta dirigentes?
– NO2, – Cl, – Br
– CHO, – NH2, – CH3
– SO3H, – NO2, – COOH
– CH3, – Cl, – NH2
– CH3, – NO2, – COOH
Os álcoois podem ser classificados em primários, secundários e terciários. De acordo com essa classificação é possível prever qual será o produto principal formado diante de reações de oxidação. A combustão, ou seja, a queima que ocorre com o etanol nos automóveis, pode ser considerada também uma reação de oxidação. Dentre os produtos formados na oxidação do etanol nos automóveis estão os aldeídos, isso se deve a:
fragmentação da molécula do álcool.
oxidação parcial do álcool.
reação do álcool com o nitrogênio do ar.
oxidação completa do álcool.
redução do álcool.
As fórmulas estruturais de alguns componentes de óleos essenciais, responsáveis pelo aroma de certas ervas e flores, são:
 Dentre esses compostos, são isômeros:
Dentre esses compostos, são isômeros:
anetol e linalol.
linalol e citronelal.
eugenol e linalol.
citronelal e eugenol.
eugenol e anetol.
Analise as estruturas químicas: α-naftol, etanol e ácido etanóico, e através de suas funções orgânicas é possível classifique-as respectivamente em:

F – F – F
V – V – F
V – F – F
F – V – V
V – F – V
O cloranfenicol é uma substância que tem propriedade antibacteriana e por isso é utilizado como antibiótico em seres humanos e animais.
 Com relação à estrutura do cloranfenicol, considere as seguintes afirmativas:
Com relação à estrutura do cloranfenicol, considere as seguintes afirmativas:
1. A substância apresenta um grupo amino ligado ao anel aromático.
2. Existe um grupamento álcool em carbono terciário na estrutura.
3. Esse composto apresenta dois átomos de carbono assimétricos (quirais).
4. A molécula apresenta o grupo funcional cetona.
5. O anel aromático presente na estrutura é para-dissubstituído.
Assinale a alternativa correta:
Somente as afirmativas 3 e 5 são verdadeiras.
Somente as afirmativas 1 e 2 são verdadeiras.
Somente as afirmativas 1, 2 e 3 são verdadeiras.
Somente as afirmativas 4 e 5 são verdadeiras.
Somente a afirmativa 4 é verdadeira.
Os grupos orientadores ligados ao anel aromático podem ser classificados como ativantes (orto para dirigentes) ou desativantes (meta dirigentes). Qual alternativa a seguir, contém apenas grupos meta dirigentes?
– NO2, – Cl, – Br
– CHO, – NH2, – CH3
– SO3H, – NO2, – COOH
– CH3, – Cl, – NH2
– CH3, – NO2, – COOH
Os álcoois podem ser classificados em primários, secundários e terciários. De acordo com essa classificação é possível prever qual será o produto principal formado diante de reações de oxidação. A combustão, ou seja, a queima que ocorre com o etanol nos automóveis, pode ser considerada também uma reação de oxidação. Dentre os produtos formados na oxidação do etanol nos automóveis estão os aldeídos, isso se deve a:
fragmentação da molécula do álcool.
oxidação parcial do álcool.
reação do álcool com o nitrogênio do ar.
oxidação completa do álcool.
redução do álcool.
As fórmulas estruturais de alguns componentes de óleos essenciais, responsáveis pelo aroma de certas ervas e flores, são:
 Dentre esses compostos, são isômeros:
Dentre esses compostos, são isômeros:
anetol e linalol.
linalol e citronelal.
eugenol e linalol.
citronelal e eugenol.
eugenol e anetol.
Analise as estruturas químicas: α-naftol, etanol e ácido etanóico, e através de suas funções orgânicas é possível classifique-as respectivamente em:

Somente as afirmativas 3 e 5 são verdadeiras.
Somente as afirmativas 1 e 2 são verdadeiras.
Somente as afirmativas 1, 2 e 3 são verdadeiras.
Somente as afirmativas 4 e 5 são verdadeiras.
Somente a afirmativa 4 é verdadeira.
Os grupos orientadores ligados ao anel aromático podem ser classificados como ativantes (orto para dirigentes) ou desativantes (meta dirigentes). Qual alternativa a seguir, contém apenas grupos meta dirigentes?
– NO2, – Cl, – Br
– CHO, – NH2, – CH3
– SO3H, – NO2, – COOH
– CH3, – Cl, – NH2
– CH3, – NO2, – COOH
Os álcoois podem ser classificados em primários, secundários e terciários. De acordo com essa classificação é possível prever qual será o produto principal formado diante de reações de oxidação. A combustão, ou seja, a queima que ocorre com o etanol nos automóveis, pode ser considerada também uma reação de oxidação. Dentre os produtos formados na oxidação do etanol nos automóveis estão os aldeídos, isso se deve a:
fragmentação da molécula do álcool.
oxidação parcial do álcool.
reação do álcool com o nitrogênio do ar.
oxidação completa do álcool.
redução do álcool.
As fórmulas estruturais de alguns componentes de óleos essenciais, responsáveis pelo aroma de certas ervas e flores, são:
 Dentre esses compostos, são isômeros:
Dentre esses compostos, são isômeros:
anetol e linalol.
linalol e citronelal.
eugenol e linalol.
citronelal e eugenol.
eugenol e anetol.
Analise as estruturas químicas: α-naftol, etanol e ácido etanóico, e através de suas funções orgânicas é possível classifique-as respectivamente em:

– NO2, – Cl, – Br
– CHO, – NH2, – CH3
– SO3H, – NO2, – COOH
– CH3, – Cl, – NH2
– CH3, – NO2, – COOH
Os álcoois podem ser classificados em primários, secundários e terciários. De acordo com essa classificação é possível prever qual será o produto principal formado diante de reações de oxidação. A combustão, ou seja, a queima que ocorre com o etanol nos automóveis, pode ser considerada também uma reação de oxidação. Dentre os produtos formados na oxidação do etanol nos automóveis estão os aldeídos, isso se deve a:
fragmentação da molécula do álcool.
oxidação parcial do álcool.
reação do álcool com o nitrogênio do ar.
oxidação completa do álcool.
redução do álcool.
As fórmulas estruturais de alguns componentes de óleos essenciais, responsáveis pelo aroma de certas ervas e flores, são:
 Dentre esses compostos, são isômeros:
Dentre esses compostos, são isômeros:
anetol e linalol.
linalol e citronelal.
eugenol e linalol.
citronelal e eugenol.
eugenol e anetol.
Analise as estruturas químicas: α-naftol, etanol e ácido etanóico, e através de suas funções orgânicas é possível classifique-as respectivamente em:

fragmentação da molécula do álcool.
oxidação parcial do álcool.
reação do álcool com o nitrogênio do ar.
oxidação completa do álcool.
redução do álcool.
As fórmulas estruturais de alguns componentes de óleos essenciais, responsáveis pelo aroma de certas ervas e flores, são:
 Dentre esses compostos, são isômeros:
Dentre esses compostos, são isômeros:
anetol e linalol.
linalol e citronelal.
eugenol e linalol.
citronelal e eugenol.
eugenol e anetol.
Analise as estruturas químicas: α-naftol, etanol e ácido etanóico, e através de suas funções orgânicas é possível classifique-as respectivamente em:

anetol e linalol.
linalol e citronelal.
eugenol e linalol.
citronelal e eugenol.
eugenol e anetol.
Analise as estruturas químicas: α-naftol, etanol e ácido etanóico, e através de suas funções orgânicas é possível classifique-as respectivamente em:

