QUÍMICA ANALÍTICA
A titulação de 50mL de uma base forte com ácido forte 0,1mol/L, que reagem com estequiometria 1:1, pode ser representada através do gráfico, onde P.E. = ponto de equivalência.
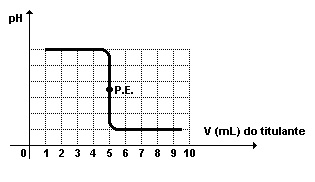 Considerando a informação dada, assinale a alternativa correta.
Considerando a informação dada, assinale a alternativa correta.
A concentração da base é 1,0 mol/L.
A concentração da base é 0,05 mol/L.
A concentração da base é 0,01 mol/L.
O pH no P.E. é 12,0.
O pH da base é 12,7.
Podem ocorrer situações de tamponamento de pH, desde valores mais baixos, de grande acidez com elevada concentração hidrogeniónica, [H3O+], até valores mais altos, de elevada alcalinidade com altas concentrações de íons hidroxilo, [OH-], passando por situações de acidez intermédia. Calcule o pH de uma solução tampão formada por metanoato de sódio 0,3 mol/L com ácido metanoico 0,3 mol/L. Dados: Ka = 1,8x10-4
2,35
10,25
3,74
11,25
8,40
Hidrólise salina é o processo em que íons provenientes de um sal reagem com a água. A palavra Hidrólise significa reação de decomposição de uma substância pela água. Calcule o pH de uma solução 0,2 mol/L de KBr Dados: Kw = 1x10-14.
14,0
10,5
7,0
9,8
2,85
Uma solução salina pode originar soluções ácidas e básicas. Os sais presentes se dissociam em cátions e ânions, e dependendo destes íons a solução assume diferentes valores de pH. Calcule o pH de uma solução de NH4Cl cuja concentração é 0,35 mol/L. Dados: Kb = 1,8x10-5; Kw = 1x10-14.
13,5
9,15
11,13
2,87
4,85
Quando temos sais que ambos os íons hidrolisam, o pH depende do íon que hidrolisa em maior extensão. Sabemos isto olhando o Ka e Kb dos íons. Calcule o pH de uma solução 0,1 mol/L de cianeto de amônio (NH4CN. Dados: Ka HCN = 4,9x10-10, Kb NH3 = 1,8x10-5 e Kw = 1x10-14.
11,15
2,85
9,8
10,5
3,85
Em água pura, a 25ºC, as concentrações molares de H+ e OH- são iguais e são conhecidas experimentalmente como sendo 1x10-7 mol/L. Em uma análise de rotina de uma amostra de solo, o analista descobriu que o pH da amostra era de 8,2. Sendo assim, calcule a quantidade de H+ e OH- presente nessa amostra. Dados Kw = 1x10-14.
[OH-] = 1,585x10-6 mol/L e [H+] = 7,31x10-9 mol/L
[H+] = 1,585x10-6 mol/L e [OH-] = 6,31x10-9 mol/L
[H+] = 2,585x10-6 mol/L e [OH-] = 6,31x10-9 mol/L
[OH-] = 2,585x10-6 mol/L e [H+] = 6,31x10-9 mol/L
[OH-] = 1,585x10-6 mol/L e [H+] = 6,31x10-9 mol/L
“Chuva ácida” é um termo que se refere à precipitação, a partir da atmosfera, de chuva com quantidades de ácidos nítrico e sulfúrico maiores que o normal. Os precursores da chuva ácida vêm tanto de fontes naturais, tais como vulcões e vegetação em decomposição, quanto de processos industriais, principalmente emissões de dióxido de enxofre e óxidos de nitrogênio resultantes da queima de combustíveis fósseis. O pH da água da chuva considerado normal é de 5,5 (devido à presença de ácido carbônico proveniente da solubilização de dióxido de carbono). Um químico monitorando uma região altamente industrializada observou que o pH da água da chuva era igual a 4,5. Considerando que a acidez está relacionada com a concentração de H3O+, calcule a concentração de íons H+ e OH- para a chuva ácida. Dados Kw = 1x10-14.
[H+] = 3,16x10-10 mol/L e [OH-] = 3,16x10-5 mol/L
[H+] = 3,16x10-5 mol/L e [OH-] = 3,16x10-10 mol/L
[H+] = 4,16x10-5 mol/L e [OH-] = 3,16x10-10 mol/L
[H+] = 5,16x10-5 mol/L e [OH-] = 5,16x10-10 mol/L
[H+] = 3,16x10-5 mol/L e [OH-] = 4,16x10-10 mol/L
Os testes qualitativos são baseados e reações de neutralização, precipitação, complexação e oxirredução. De uma maneira geral, as execuções dos testes qualitativos são bem simples e os resultados obtidos, quando interpretados corretamente, oferecem informações rápidas, de baixo custo e com resultados criticamente confiáveis. Os cátions e os ânions são divididos em grupos, devido a suas similaridades reacionais. Com base dessas informações responda quais os reagentes utilizados para a identificação de cátions dos grupos III e IV respectivamente?

A concentração da base é 1,0 mol/L.
A concentração da base é 0,05 mol/L.
A concentração da base é 0,01 mol/L.
O pH no P.E. é 12,0.
O pH da base é 12,7.
Podem ocorrer situações de tamponamento de pH, desde valores mais baixos, de grande acidez com elevada concentração hidrogeniónica, [H3O+], até valores mais altos, de elevada alcalinidade com altas concentrações de íons hidroxilo, [OH-], passando por situações de acidez intermédia. Calcule o pH de uma solução tampão formada por metanoato de sódio 0,3 mol/L com ácido metanoico 0,3 mol/L. Dados: Ka = 1,8x10-4
2,35
10,25
3,74
11,25
8,40
Hidrólise salina é o processo em que íons provenientes de um sal reagem com a água. A palavra Hidrólise significa reação de decomposição de uma substância pela água. Calcule o pH de uma solução 0,2 mol/L de KBr Dados: Kw = 1x10-14.
14,0
10,5
7,0
9,8
2,85
Uma solução salina pode originar soluções ácidas e básicas. Os sais presentes se dissociam em cátions e ânions, e dependendo destes íons a solução assume diferentes valores de pH. Calcule o pH de uma solução de NH4Cl cuja concentração é 0,35 mol/L. Dados: Kb = 1,8x10-5; Kw = 1x10-14.
13,5
9,15
11,13
2,87
4,85
Quando temos sais que ambos os íons hidrolisam, o pH depende do íon que hidrolisa em maior extensão. Sabemos isto olhando o Ka e Kb dos íons. Calcule o pH de uma solução 0,1 mol/L de cianeto de amônio (NH4CN. Dados: Ka HCN = 4,9x10-10, Kb NH3 = 1,8x10-5 e Kw = 1x10-14.
11,15
2,85
9,8
10,5
3,85
Em água pura, a 25ºC, as concentrações molares de H+ e OH- são iguais e são conhecidas experimentalmente como sendo 1x10-7 mol/L. Em uma análise de rotina de uma amostra de solo, o analista descobriu que o pH da amostra era de 8,2. Sendo assim, calcule a quantidade de H+ e OH- presente nessa amostra. Dados Kw = 1x10-14.
[OH-] = 1,585x10-6 mol/L e [H+] = 7,31x10-9 mol/L
[H+] = 1,585x10-6 mol/L e [OH-] = 6,31x10-9 mol/L
[H+] = 2,585x10-6 mol/L e [OH-] = 6,31x10-9 mol/L
[OH-] = 2,585x10-6 mol/L e [H+] = 6,31x10-9 mol/L
[OH-] = 1,585x10-6 mol/L e [H+] = 6,31x10-9 mol/L
“Chuva ácida” é um termo que se refere à precipitação, a partir da atmosfera, de chuva com quantidades de ácidos nítrico e sulfúrico maiores que o normal. Os precursores da chuva ácida vêm tanto de fontes naturais, tais como vulcões e vegetação em decomposição, quanto de processos industriais, principalmente emissões de dióxido de enxofre e óxidos de nitrogênio resultantes da queima de combustíveis fósseis. O pH da água da chuva considerado normal é de 5,5 (devido à presença de ácido carbônico proveniente da solubilização de dióxido de carbono). Um químico monitorando uma região altamente industrializada observou que o pH da água da chuva era igual a 4,5. Considerando que a acidez está relacionada com a concentração de H3O+, calcule a concentração de íons H+ e OH- para a chuva ácida. Dados Kw = 1x10-14.
[H+] = 3,16x10-10 mol/L e [OH-] = 3,16x10-5 mol/L
[H+] = 3,16x10-5 mol/L e [OH-] = 3,16x10-10 mol/L
[H+] = 4,16x10-5 mol/L e [OH-] = 3,16x10-10 mol/L
[H+] = 5,16x10-5 mol/L e [OH-] = 5,16x10-10 mol/L
[H+] = 3,16x10-5 mol/L e [OH-] = 4,16x10-10 mol/L
Os testes qualitativos são baseados e reações de neutralização, precipitação, complexação e oxirredução. De uma maneira geral, as execuções dos testes qualitativos são bem simples e os resultados obtidos, quando interpretados corretamente, oferecem informações rápidas, de baixo custo e com resultados criticamente confiáveis. Os cátions e os ânions são divididos em grupos, devido a suas similaridades reacionais. Com base dessas informações responda quais os reagentes utilizados para a identificação de cátions dos grupos III e IV respectivamente?
2,35
10,25
3,74
11,25
8,40
Hidrólise salina é o processo em que íons provenientes de um sal reagem com a água. A palavra Hidrólise significa reação de decomposição de uma substância pela água. Calcule o pH de uma solução 0,2 mol/L de KBr Dados: Kw = 1x10-14.
14,0
10,5
7,0
9,8
2,85
Uma solução salina pode originar soluções ácidas e básicas. Os sais presentes se dissociam em cátions e ânions, e dependendo destes íons a solução assume diferentes valores de pH. Calcule o pH de uma solução de NH4Cl cuja concentração é 0,35 mol/L. Dados: Kb = 1,8x10-5; Kw = 1x10-14.
13,5
9,15
11,13
2,87
4,85
Quando temos sais que ambos os íons hidrolisam, o pH depende do íon que hidrolisa em maior extensão. Sabemos isto olhando o Ka e Kb dos íons. Calcule o pH de uma solução 0,1 mol/L de cianeto de amônio (NH4CN. Dados: Ka HCN = 4,9x10-10, Kb NH3 = 1,8x10-5 e Kw = 1x10-14.
11,15
2,85
9,8
10,5
3,85
Em água pura, a 25ºC, as concentrações molares de H+ e OH- são iguais e são conhecidas experimentalmente como sendo 1x10-7 mol/L. Em uma análise de rotina de uma amostra de solo, o analista descobriu que o pH da amostra era de 8,2. Sendo assim, calcule a quantidade de H+ e OH- presente nessa amostra. Dados Kw = 1x10-14.
[OH-] = 1,585x10-6 mol/L e [H+] = 7,31x10-9 mol/L
[H+] = 1,585x10-6 mol/L e [OH-] = 6,31x10-9 mol/L
[H+] = 2,585x10-6 mol/L e [OH-] = 6,31x10-9 mol/L
[OH-] = 2,585x10-6 mol/L e [H+] = 6,31x10-9 mol/L
[OH-] = 1,585x10-6 mol/L e [H+] = 6,31x10-9 mol/L
“Chuva ácida” é um termo que se refere à precipitação, a partir da atmosfera, de chuva com quantidades de ácidos nítrico e sulfúrico maiores que o normal. Os precursores da chuva ácida vêm tanto de fontes naturais, tais como vulcões e vegetação em decomposição, quanto de processos industriais, principalmente emissões de dióxido de enxofre e óxidos de nitrogênio resultantes da queima de combustíveis fósseis. O pH da água da chuva considerado normal é de 5,5 (devido à presença de ácido carbônico proveniente da solubilização de dióxido de carbono). Um químico monitorando uma região altamente industrializada observou que o pH da água da chuva era igual a 4,5. Considerando que a acidez está relacionada com a concentração de H3O+, calcule a concentração de íons H+ e OH- para a chuva ácida. Dados Kw = 1x10-14.
[H+] = 3,16x10-10 mol/L e [OH-] = 3,16x10-5 mol/L
[H+] = 3,16x10-5 mol/L e [OH-] = 3,16x10-10 mol/L
[H+] = 4,16x10-5 mol/L e [OH-] = 3,16x10-10 mol/L
[H+] = 5,16x10-5 mol/L e [OH-] = 5,16x10-10 mol/L
[H+] = 3,16x10-5 mol/L e [OH-] = 4,16x10-10 mol/L
Os testes qualitativos são baseados e reações de neutralização, precipitação, complexação e oxirredução. De uma maneira geral, as execuções dos testes qualitativos são bem simples e os resultados obtidos, quando interpretados corretamente, oferecem informações rápidas, de baixo custo e com resultados criticamente confiáveis. Os cátions e os ânions são divididos em grupos, devido a suas similaridades reacionais. Com base dessas informações responda quais os reagentes utilizados para a identificação de cátions dos grupos III e IV respectivamente?
14,0
10,5
7,0
9,8
2,85
Uma solução salina pode originar soluções ácidas e básicas. Os sais presentes se dissociam em cátions e ânions, e dependendo destes íons a solução assume diferentes valores de pH. Calcule o pH de uma solução de NH4Cl cuja concentração é 0,35 mol/L. Dados: Kb = 1,8x10-5; Kw = 1x10-14.
13,5
9,15
11,13
2,87
4,85
Quando temos sais que ambos os íons hidrolisam, o pH depende do íon que hidrolisa em maior extensão. Sabemos isto olhando o Ka e Kb dos íons. Calcule o pH de uma solução 0,1 mol/L de cianeto de amônio (NH4CN. Dados: Ka HCN = 4,9x10-10, Kb NH3 = 1,8x10-5 e Kw = 1x10-14.
11,15
2,85
9,8
10,5
3,85
Em água pura, a 25ºC, as concentrações molares de H+ e OH- são iguais e são conhecidas experimentalmente como sendo 1x10-7 mol/L. Em uma análise de rotina de uma amostra de solo, o analista descobriu que o pH da amostra era de 8,2. Sendo assim, calcule a quantidade de H+ e OH- presente nessa amostra. Dados Kw = 1x10-14.
[OH-] = 1,585x10-6 mol/L e [H+] = 7,31x10-9 mol/L
[H+] = 1,585x10-6 mol/L e [OH-] = 6,31x10-9 mol/L
[H+] = 2,585x10-6 mol/L e [OH-] = 6,31x10-9 mol/L
[OH-] = 2,585x10-6 mol/L e [H+] = 6,31x10-9 mol/L
[OH-] = 1,585x10-6 mol/L e [H+] = 6,31x10-9 mol/L
“Chuva ácida” é um termo que se refere à precipitação, a partir da atmosfera, de chuva com quantidades de ácidos nítrico e sulfúrico maiores que o normal. Os precursores da chuva ácida vêm tanto de fontes naturais, tais como vulcões e vegetação em decomposição, quanto de processos industriais, principalmente emissões de dióxido de enxofre e óxidos de nitrogênio resultantes da queima de combustíveis fósseis. O pH da água da chuva considerado normal é de 5,5 (devido à presença de ácido carbônico proveniente da solubilização de dióxido de carbono). Um químico monitorando uma região altamente industrializada observou que o pH da água da chuva era igual a 4,5. Considerando que a acidez está relacionada com a concentração de H3O+, calcule a concentração de íons H+ e OH- para a chuva ácida. Dados Kw = 1x10-14.
[H+] = 3,16x10-10 mol/L e [OH-] = 3,16x10-5 mol/L
[H+] = 3,16x10-5 mol/L e [OH-] = 3,16x10-10 mol/L
[H+] = 4,16x10-5 mol/L e [OH-] = 3,16x10-10 mol/L
[H+] = 5,16x10-5 mol/L e [OH-] = 5,16x10-10 mol/L
[H+] = 3,16x10-5 mol/L e [OH-] = 4,16x10-10 mol/L
Os testes qualitativos são baseados e reações de neutralização, precipitação, complexação e oxirredução. De uma maneira geral, as execuções dos testes qualitativos são bem simples e os resultados obtidos, quando interpretados corretamente, oferecem informações rápidas, de baixo custo e com resultados criticamente confiáveis. Os cátions e os ânions são divididos em grupos, devido a suas similaridades reacionais. Com base dessas informações responda quais os reagentes utilizados para a identificação de cátions dos grupos III e IV respectivamente?
13,5
9,15
11,13
2,87
4,85
Quando temos sais que ambos os íons hidrolisam, o pH depende do íon que hidrolisa em maior extensão. Sabemos isto olhando o Ka e Kb dos íons. Calcule o pH de uma solução 0,1 mol/L de cianeto de amônio (NH4CN. Dados: Ka HCN = 4,9x10-10, Kb NH3 = 1,8x10-5 e Kw = 1x10-14.
11,15
2,85
9,8
10,5
3,85
Em água pura, a 25ºC, as concentrações molares de H+ e OH- são iguais e são conhecidas experimentalmente como sendo 1x10-7 mol/L. Em uma análise de rotina de uma amostra de solo, o analista descobriu que o pH da amostra era de 8,2. Sendo assim, calcule a quantidade de H+ e OH- presente nessa amostra. Dados Kw = 1x10-14.
[OH-] = 1,585x10-6 mol/L e [H+] = 7,31x10-9 mol/L
[H+] = 1,585x10-6 mol/L e [OH-] = 6,31x10-9 mol/L
[H+] = 2,585x10-6 mol/L e [OH-] = 6,31x10-9 mol/L
[OH-] = 2,585x10-6 mol/L e [H+] = 6,31x10-9 mol/L
[OH-] = 1,585x10-6 mol/L e [H+] = 6,31x10-9 mol/L
“Chuva ácida” é um termo que se refere à precipitação, a partir da atmosfera, de chuva com quantidades de ácidos nítrico e sulfúrico maiores que o normal. Os precursores da chuva ácida vêm tanto de fontes naturais, tais como vulcões e vegetação em decomposição, quanto de processos industriais, principalmente emissões de dióxido de enxofre e óxidos de nitrogênio resultantes da queima de combustíveis fósseis. O pH da água da chuva considerado normal é de 5,5 (devido à presença de ácido carbônico proveniente da solubilização de dióxido de carbono). Um químico monitorando uma região altamente industrializada observou que o pH da água da chuva era igual a 4,5. Considerando que a acidez está relacionada com a concentração de H3O+, calcule a concentração de íons H+ e OH- para a chuva ácida. Dados Kw = 1x10-14.
[H+] = 3,16x10-10 mol/L e [OH-] = 3,16x10-5 mol/L
[H+] = 3,16x10-5 mol/L e [OH-] = 3,16x10-10 mol/L
[H+] = 4,16x10-5 mol/L e [OH-] = 3,16x10-10 mol/L
[H+] = 5,16x10-5 mol/L e [OH-] = 5,16x10-10 mol/L
[H+] = 3,16x10-5 mol/L e [OH-] = 4,16x10-10 mol/L
Os testes qualitativos são baseados e reações de neutralização, precipitação, complexação e oxirredução. De uma maneira geral, as execuções dos testes qualitativos são bem simples e os resultados obtidos, quando interpretados corretamente, oferecem informações rápidas, de baixo custo e com resultados criticamente confiáveis. Os cátions e os ânions são divididos em grupos, devido a suas similaridades reacionais. Com base dessas informações responda quais os reagentes utilizados para a identificação de cátions dos grupos III e IV respectivamente?
11,15
2,85
9,8
10,5
3,85
Em água pura, a 25ºC, as concentrações molares de H+ e OH- são iguais e são conhecidas experimentalmente como sendo 1x10-7 mol/L. Em uma análise de rotina de uma amostra de solo, o analista descobriu que o pH da amostra era de 8,2. Sendo assim, calcule a quantidade de H+ e OH- presente nessa amostra. Dados Kw = 1x10-14.
[OH-] = 1,585x10-6 mol/L e [H+] = 7,31x10-9 mol/L
[H+] = 1,585x10-6 mol/L e [OH-] = 6,31x10-9 mol/L
[H+] = 2,585x10-6 mol/L e [OH-] = 6,31x10-9 mol/L
[OH-] = 2,585x10-6 mol/L e [H+] = 6,31x10-9 mol/L
[OH-] = 1,585x10-6 mol/L e [H+] = 6,31x10-9 mol/L
“Chuva ácida” é um termo que se refere à precipitação, a partir da atmosfera, de chuva com quantidades de ácidos nítrico e sulfúrico maiores que o normal. Os precursores da chuva ácida vêm tanto de fontes naturais, tais como vulcões e vegetação em decomposição, quanto de processos industriais, principalmente emissões de dióxido de enxofre e óxidos de nitrogênio resultantes da queima de combustíveis fósseis. O pH da água da chuva considerado normal é de 5,5 (devido à presença de ácido carbônico proveniente da solubilização de dióxido de carbono). Um químico monitorando uma região altamente industrializada observou que o pH da água da chuva era igual a 4,5. Considerando que a acidez está relacionada com a concentração de H3O+, calcule a concentração de íons H+ e OH- para a chuva ácida. Dados Kw = 1x10-14.
[H+] = 3,16x10-10 mol/L e [OH-] = 3,16x10-5 mol/L
[H+] = 3,16x10-5 mol/L e [OH-] = 3,16x10-10 mol/L
[H+] = 4,16x10-5 mol/L e [OH-] = 3,16x10-10 mol/L
[H+] = 5,16x10-5 mol/L e [OH-] = 5,16x10-10 mol/L
[H+] = 3,16x10-5 mol/L e [OH-] = 4,16x10-10 mol/L
Os testes qualitativos são baseados e reações de neutralização, precipitação, complexação e oxirredução. De uma maneira geral, as execuções dos testes qualitativos são bem simples e os resultados obtidos, quando interpretados corretamente, oferecem informações rápidas, de baixo custo e com resultados criticamente confiáveis. Os cátions e os ânions são divididos em grupos, devido a suas similaridades reacionais. Com base dessas informações responda quais os reagentes utilizados para a identificação de cátions dos grupos III e IV respectivamente?
[OH-] = 1,585x10-6 mol/L e [H+] = 7,31x10-9 mol/L
[H+] = 1,585x10-6 mol/L e [OH-] = 6,31x10-9 mol/L
[H+] = 2,585x10-6 mol/L e [OH-] = 6,31x10-9 mol/L
[OH-] = 2,585x10-6 mol/L e [H+] = 6,31x10-9 mol/L
[OH-] = 1,585x10-6 mol/L e [H+] = 6,31x10-9 mol/L
“Chuva ácida” é um termo que se refere à precipitação, a partir da atmosfera, de chuva com quantidades de ácidos nítrico e sulfúrico maiores que o normal. Os precursores da chuva ácida vêm tanto de fontes naturais, tais como vulcões e vegetação em decomposição, quanto de processos industriais, principalmente emissões de dióxido de enxofre e óxidos de nitrogênio resultantes da queima de combustíveis fósseis. O pH da água da chuva considerado normal é de 5,5 (devido à presença de ácido carbônico proveniente da solubilização de dióxido de carbono). Um químico monitorando uma região altamente industrializada observou que o pH da água da chuva era igual a 4,5. Considerando que a acidez está relacionada com a concentração de H3O+, calcule a concentração de íons H+ e OH- para a chuva ácida. Dados Kw = 1x10-14.
[H+] = 3,16x10-10 mol/L e [OH-] = 3,16x10-5 mol/L
[H+] = 3,16x10-5 mol/L e [OH-] = 3,16x10-10 mol/L
[H+] = 4,16x10-5 mol/L e [OH-] = 3,16x10-10 mol/L
[H+] = 5,16x10-5 mol/L e [OH-] = 5,16x10-10 mol/L
[H+] = 3,16x10-5 mol/L e [OH-] = 4,16x10-10 mol/L
Os testes qualitativos são baseados e reações de neutralização, precipitação, complexação e oxirredução. De uma maneira geral, as execuções dos testes qualitativos são bem simples e os resultados obtidos, quando interpretados corretamente, oferecem informações rápidas, de baixo custo e com resultados criticamente confiáveis. Os cátions e os ânions são divididos em grupos, devido a suas similaridades reacionais. Com base dessas informações responda quais os reagentes utilizados para a identificação de cátions dos grupos III e IV respectivamente?
[H+] = 3,16x10-10 mol/L e [OH-] = 3,16x10-5 mol/L
[H+] = 3,16x10-5 mol/L e [OH-] = 3,16x10-10 mol/L
[H+] = 4,16x10-5 mol/L e [OH-] = 3,16x10-10 mol/L
[H+] = 5,16x10-5 mol/L e [OH-] = 5,16x10-10 mol/L
[H+] = 3,16x10-5 mol/L e [OH-] = 4,16x10-10 mol/L