QUÍMICA ORGÂNICA II
As reações abaixo podem ocorrer através de substituições nucleofílicas do tipo Sn1 ou Sn2. A reação de substituição classificada como Sn1 ocorre via formação de carbocátion, e a Sn2, o nucleófilo faz o ataque por trás do grupo abandonador formando um produto com configuração invertida. Considerando os conceitos de substituição nucleofílica, com relação à classificação das reações 1 e 2 abaixo e a natureza do grupo abandonador cloro, pode-se afirmar que:
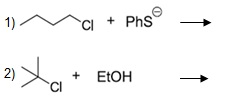
Sn1 e Sn2; o cloro é um bom grupo abandonador, pois forma uma base estável.
Sn1 e Sn2; o cloro não é um bom grupo abandonador porque forma uma base instável.
Sn2 e Sn2; o cloro é um bom grupo abandonador, pois forma uma base estável.
Sn1 e Sn1; o cloro sai na forma de Cl- e pode ser considerado uma base forte.
Sn2 e Sn1; o cloro sai na forma de Cl- pelo fato de ser uma base fraca.
Para entendermos o mecanismo de reações orgânicas, torna-se extremamente importante entender o conceito ácido-base de Bronsted-Lowry. Pois segundo essa definição:
Base é uma espécie capaz de doar um próton.
Ácido é uma espécie capaz de doar um próton.
Uma base é considerada como um eletrófilo.
Um ácido é considerado como um nucléofilo.
Ácido é uma espécie capaz de receber um próton.
Substâncias químicas, como o hidreto de lítio e alumínio e boroidreto de sódio são agentes redutores mais utilizados em síntese orgânica. Processando-se a reação de redução entre a propanona e hidreto de lítio e alumínio qual será o produto formado? Escolha a alternativa que apresenta o produto da reação.
Propanal-2
Propanona-2
Propano
Propeno
Propanol-2
O álcool é um nucleófilo fraco, portanto é necessário um catalisador ácido para que a reação com um aldeído aconteça com maior velocidade. Sabendo que o produto da adição de um álcool a um aldeído é chamado de hemiacetal, qual será o produto formado quando um álcool é adicionado à um hemiacetal?
Acetal
Cetal
Cetona
Aldeído
Hemicetal
Os anidridos de ácidos carboxílicos são compostos que apresentam em sua estrutura química um átomo de oxigênio ligado a dois grupos carbonílicos com dois radicais orgânicos. Sobre os anidridos, marque a alternativa correta.
Os anidridos simétricos são nomeados pelo nome do ácido carboxílico correspondente.
A palavra anidrido significa com água.
Se as duas moléculas de ácido carboxílico que formam o anidrido forem iguais, o anidrido será chamado de assimétrico.
Se as duas moléculas de ácido carboxílico que formam o anidrido forem diferentes, o anidrido será chamado de simétrico.
Os anidridos mistos são nomeados mantendo o nome de apenas um ácido carboxílico.
Em toda reação química é necessário que aconteça a quebra de uma ligação para formação de outra substância. Essa quebra pode acontecer de duas formas: cisão homolítica e heterolítica. Sobre essas duas formas de quebra de ligação, marque a alternativa correta.
Na cisão heterolítica, o par de elétrons da ligação ficará com apenas uma das espécies.
Na cisão homolítica, o par de elétrons da ligação ficará com apenas um átomo que compõe a ligação.
Na cisão heterolítica, pode ocorrer a formação de espécies radicalares.
A cisão homolítica é mais comum de acontecer que a cisão heterolítica.
Na cisão heterolítica, o par de elétrons da ligação é dividido entre os átomos que compõe a ligação.
Conhecido por ser uma solução para emagrecer rapidamente a sibutramina é um fármaco utilizado no tratamento da obesidade. Classificado no grupo dos medicamentos inibidores seletivos da recaptação da serotonina e norepinefrina, é em outras palavras, um moderador de apetite que faz com que a pessoa não sinta fome e consuma menos calorias. A estrutura da sibutramina está representada a seguir e com base nessa estrutura, pode-se afirmar que:
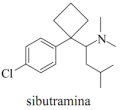
É um ácido de Arrhenius, porque possui um átomo de nitrogênio capaz de doar próton.
É uma base de Lewis, porque possui um átomo de nitrogênio que pode receber um par de elétrons de um ácido.
É um ácido de Bronsted-Lowry, porque possui um átomo de nitrogênio terciário.
É um ácido de Lewis, porque possui um átomo de nitrogênio capaz de receber um par de elétrons de um ácido.
É uma base de Lewis, porque possui um átomo de nitrogênio que pode doar um par de elétrons para ácidos.
Os ácidos orgânicos e os fenóis possuem caráter ácido, ou seja, ionizam liberando íons H+ quando em solução aquosa. Mas quando comparados aos ácidos inorgânicos, são bem mais fracos. No entanto, a presença de determinados grupos ligados ao átomo de carbono, provoca um aumento na ionização do composto. Considere uma substância representada pela estrutura abaixo:
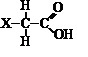 A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:
A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:
CH2CH3
F
H
CH3
I
Os ácidos carboxílicos são compostos orgânicos que apresentam o mais pronunciado caráter ácido, muito embora sejam considerados ácidos fracos. Quando em solução aquosa, liberam íon hidrônio ou hidroxônio, como a reação a seguir:
 Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Monocloro acético.
β-cloro butanóico.
γ-iodo pentanóico.
Propanóico.
Benzóico.
O reagente de Grignard é preparado pela reação de haletos orgânicos com magnésio metálico usando um solvente aprótico, geralmente o éter etílico. Quando adicionado a aldeídos e cetonas, reage atacando o grupamento carbonila, formando um álcool de cadeia carbônica maior. Sendo assim, qual o produto da reação entre o brometo de etilmagnésio com a propanona?

Sn1 e Sn2; o cloro é um bom grupo abandonador, pois forma uma base estável.
Sn1 e Sn2; o cloro não é um bom grupo abandonador porque forma uma base instável.
Sn2 e Sn2; o cloro é um bom grupo abandonador, pois forma uma base estável.
Sn1 e Sn1; o cloro sai na forma de Cl- e pode ser considerado uma base forte.
Sn2 e Sn1; o cloro sai na forma de Cl- pelo fato de ser uma base fraca.
Para entendermos o mecanismo de reações orgânicas, torna-se extremamente importante entender o conceito ácido-base de Bronsted-Lowry. Pois segundo essa definição:
Base é uma espécie capaz de doar um próton.
Ácido é uma espécie capaz de doar um próton.
Uma base é considerada como um eletrófilo.
Um ácido é considerado como um nucléofilo.
Ácido é uma espécie capaz de receber um próton.
Substâncias químicas, como o hidreto de lítio e alumínio e boroidreto de sódio são agentes redutores mais utilizados em síntese orgânica. Processando-se a reação de redução entre a propanona e hidreto de lítio e alumínio qual será o produto formado? Escolha a alternativa que apresenta o produto da reação.
Propanal-2
Propanona-2
Propano
Propeno
Propanol-2
O álcool é um nucleófilo fraco, portanto é necessário um catalisador ácido para que a reação com um aldeído aconteça com maior velocidade. Sabendo que o produto da adição de um álcool a um aldeído é chamado de hemiacetal, qual será o produto formado quando um álcool é adicionado à um hemiacetal?
Acetal
Cetal
Cetona
Aldeído
Hemicetal
Os anidridos de ácidos carboxílicos são compostos que apresentam em sua estrutura química um átomo de oxigênio ligado a dois grupos carbonílicos com dois radicais orgânicos. Sobre os anidridos, marque a alternativa correta.
Os anidridos simétricos são nomeados pelo nome do ácido carboxílico correspondente.
A palavra anidrido significa com água.
Se as duas moléculas de ácido carboxílico que formam o anidrido forem iguais, o anidrido será chamado de assimétrico.
Se as duas moléculas de ácido carboxílico que formam o anidrido forem diferentes, o anidrido será chamado de simétrico.
Os anidridos mistos são nomeados mantendo o nome de apenas um ácido carboxílico.
Em toda reação química é necessário que aconteça a quebra de uma ligação para formação de outra substância. Essa quebra pode acontecer de duas formas: cisão homolítica e heterolítica. Sobre essas duas formas de quebra de ligação, marque a alternativa correta.
Na cisão heterolítica, o par de elétrons da ligação ficará com apenas uma das espécies.
Na cisão homolítica, o par de elétrons da ligação ficará com apenas um átomo que compõe a ligação.
Na cisão heterolítica, pode ocorrer a formação de espécies radicalares.
A cisão homolítica é mais comum de acontecer que a cisão heterolítica.
Na cisão heterolítica, o par de elétrons da ligação é dividido entre os átomos que compõe a ligação.
Conhecido por ser uma solução para emagrecer rapidamente a sibutramina é um fármaco utilizado no tratamento da obesidade. Classificado no grupo dos medicamentos inibidores seletivos da recaptação da serotonina e norepinefrina, é em outras palavras, um moderador de apetite que faz com que a pessoa não sinta fome e consuma menos calorias. A estrutura da sibutramina está representada a seguir e com base nessa estrutura, pode-se afirmar que:

É um ácido de Arrhenius, porque possui um átomo de nitrogênio capaz de doar próton.
É uma base de Lewis, porque possui um átomo de nitrogênio que pode receber um par de elétrons de um ácido.
É um ácido de Bronsted-Lowry, porque possui um átomo de nitrogênio terciário.
É um ácido de Lewis, porque possui um átomo de nitrogênio capaz de receber um par de elétrons de um ácido.
É uma base de Lewis, porque possui um átomo de nitrogênio que pode doar um par de elétrons para ácidos.
Os ácidos orgânicos e os fenóis possuem caráter ácido, ou seja, ionizam liberando íons H+ quando em solução aquosa. Mas quando comparados aos ácidos inorgânicos, são bem mais fracos. No entanto, a presença de determinados grupos ligados ao átomo de carbono, provoca um aumento na ionização do composto. Considere uma substância representada pela estrutura abaixo:
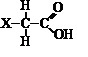 A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:
A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:
CH2CH3
F
H
CH3
I
Os ácidos carboxílicos são compostos orgânicos que apresentam o mais pronunciado caráter ácido, muito embora sejam considerados ácidos fracos. Quando em solução aquosa, liberam íon hidrônio ou hidroxônio, como a reação a seguir:
 Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Monocloro acético.
β-cloro butanóico.
γ-iodo pentanóico.
Propanóico.
Benzóico.
O reagente de Grignard é preparado pela reação de haletos orgânicos com magnésio metálico usando um solvente aprótico, geralmente o éter etílico. Quando adicionado a aldeídos e cetonas, reage atacando o grupamento carbonila, formando um álcool de cadeia carbônica maior. Sendo assim, qual o produto da reação entre o brometo de etilmagnésio com a propanona?
Base é uma espécie capaz de doar um próton.
Ácido é uma espécie capaz de doar um próton.
Uma base é considerada como um eletrófilo.
Um ácido é considerado como um nucléofilo.
Ácido é uma espécie capaz de receber um próton.
Substâncias químicas, como o hidreto de lítio e alumínio e boroidreto de sódio são agentes redutores mais utilizados em síntese orgânica. Processando-se a reação de redução entre a propanona e hidreto de lítio e alumínio qual será o produto formado? Escolha a alternativa que apresenta o produto da reação.
Propanal-2
Propanona-2
Propano
Propeno
Propanol-2
O álcool é um nucleófilo fraco, portanto é necessário um catalisador ácido para que a reação com um aldeído aconteça com maior velocidade. Sabendo que o produto da adição de um álcool a um aldeído é chamado de hemiacetal, qual será o produto formado quando um álcool é adicionado à um hemiacetal?
Acetal
Cetal
Cetona
Aldeído
Hemicetal
Os anidridos de ácidos carboxílicos são compostos que apresentam em sua estrutura química um átomo de oxigênio ligado a dois grupos carbonílicos com dois radicais orgânicos. Sobre os anidridos, marque a alternativa correta.
Os anidridos simétricos são nomeados pelo nome do ácido carboxílico correspondente.
A palavra anidrido significa com água.
Se as duas moléculas de ácido carboxílico que formam o anidrido forem iguais, o anidrido será chamado de assimétrico.
Se as duas moléculas de ácido carboxílico que formam o anidrido forem diferentes, o anidrido será chamado de simétrico.
Os anidridos mistos são nomeados mantendo o nome de apenas um ácido carboxílico.
Em toda reação química é necessário que aconteça a quebra de uma ligação para formação de outra substância. Essa quebra pode acontecer de duas formas: cisão homolítica e heterolítica. Sobre essas duas formas de quebra de ligação, marque a alternativa correta.
Na cisão heterolítica, o par de elétrons da ligação ficará com apenas uma das espécies.
Na cisão homolítica, o par de elétrons da ligação ficará com apenas um átomo que compõe a ligação.
Na cisão heterolítica, pode ocorrer a formação de espécies radicalares.
A cisão homolítica é mais comum de acontecer que a cisão heterolítica.
Na cisão heterolítica, o par de elétrons da ligação é dividido entre os átomos que compõe a ligação.
Conhecido por ser uma solução para emagrecer rapidamente a sibutramina é um fármaco utilizado no tratamento da obesidade. Classificado no grupo dos medicamentos inibidores seletivos da recaptação da serotonina e norepinefrina, é em outras palavras, um moderador de apetite que faz com que a pessoa não sinta fome e consuma menos calorias. A estrutura da sibutramina está representada a seguir e com base nessa estrutura, pode-se afirmar que:

É um ácido de Arrhenius, porque possui um átomo de nitrogênio capaz de doar próton.
É uma base de Lewis, porque possui um átomo de nitrogênio que pode receber um par de elétrons de um ácido.
É um ácido de Bronsted-Lowry, porque possui um átomo de nitrogênio terciário.
É um ácido de Lewis, porque possui um átomo de nitrogênio capaz de receber um par de elétrons de um ácido.
É uma base de Lewis, porque possui um átomo de nitrogênio que pode doar um par de elétrons para ácidos.
Os ácidos orgânicos e os fenóis possuem caráter ácido, ou seja, ionizam liberando íons H+ quando em solução aquosa. Mas quando comparados aos ácidos inorgânicos, são bem mais fracos. No entanto, a presença de determinados grupos ligados ao átomo de carbono, provoca um aumento na ionização do composto. Considere uma substância representada pela estrutura abaixo:
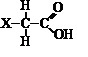 A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:
A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:
CH2CH3
F
H
CH3
I
Os ácidos carboxílicos são compostos orgânicos que apresentam o mais pronunciado caráter ácido, muito embora sejam considerados ácidos fracos. Quando em solução aquosa, liberam íon hidrônio ou hidroxônio, como a reação a seguir:
 Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Monocloro acético.
β-cloro butanóico.
γ-iodo pentanóico.
Propanóico.
Benzóico.
O reagente de Grignard é preparado pela reação de haletos orgânicos com magnésio metálico usando um solvente aprótico, geralmente o éter etílico. Quando adicionado a aldeídos e cetonas, reage atacando o grupamento carbonila, formando um álcool de cadeia carbônica maior. Sendo assim, qual o produto da reação entre o brometo de etilmagnésio com a propanona?
Propanal-2
Propanona-2
Propano
Propeno
Propanol-2
O álcool é um nucleófilo fraco, portanto é necessário um catalisador ácido para que a reação com um aldeído aconteça com maior velocidade. Sabendo que o produto da adição de um álcool a um aldeído é chamado de hemiacetal, qual será o produto formado quando um álcool é adicionado à um hemiacetal?
Acetal
Cetal
Cetona
Aldeído
Hemicetal
Os anidridos de ácidos carboxílicos são compostos que apresentam em sua estrutura química um átomo de oxigênio ligado a dois grupos carbonílicos com dois radicais orgânicos. Sobre os anidridos, marque a alternativa correta.
Os anidridos simétricos são nomeados pelo nome do ácido carboxílico correspondente.
A palavra anidrido significa com água.
Se as duas moléculas de ácido carboxílico que formam o anidrido forem iguais, o anidrido será chamado de assimétrico.
Se as duas moléculas de ácido carboxílico que formam o anidrido forem diferentes, o anidrido será chamado de simétrico.
Os anidridos mistos são nomeados mantendo o nome de apenas um ácido carboxílico.
Em toda reação química é necessário que aconteça a quebra de uma ligação para formação de outra substância. Essa quebra pode acontecer de duas formas: cisão homolítica e heterolítica. Sobre essas duas formas de quebra de ligação, marque a alternativa correta.
Na cisão heterolítica, o par de elétrons da ligação ficará com apenas uma das espécies.
Na cisão homolítica, o par de elétrons da ligação ficará com apenas um átomo que compõe a ligação.
Na cisão heterolítica, pode ocorrer a formação de espécies radicalares.
A cisão homolítica é mais comum de acontecer que a cisão heterolítica.
Na cisão heterolítica, o par de elétrons da ligação é dividido entre os átomos que compõe a ligação.
Conhecido por ser uma solução para emagrecer rapidamente a sibutramina é um fármaco utilizado no tratamento da obesidade. Classificado no grupo dos medicamentos inibidores seletivos da recaptação da serotonina e norepinefrina, é em outras palavras, um moderador de apetite que faz com que a pessoa não sinta fome e consuma menos calorias. A estrutura da sibutramina está representada a seguir e com base nessa estrutura, pode-se afirmar que:

É um ácido de Arrhenius, porque possui um átomo de nitrogênio capaz de doar próton.
É uma base de Lewis, porque possui um átomo de nitrogênio que pode receber um par de elétrons de um ácido.
É um ácido de Bronsted-Lowry, porque possui um átomo de nitrogênio terciário.
É um ácido de Lewis, porque possui um átomo de nitrogênio capaz de receber um par de elétrons de um ácido.
É uma base de Lewis, porque possui um átomo de nitrogênio que pode doar um par de elétrons para ácidos.
Os ácidos orgânicos e os fenóis possuem caráter ácido, ou seja, ionizam liberando íons H+ quando em solução aquosa. Mas quando comparados aos ácidos inorgânicos, são bem mais fracos. No entanto, a presença de determinados grupos ligados ao átomo de carbono, provoca um aumento na ionização do composto. Considere uma substância representada pela estrutura abaixo:
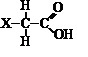 A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:
A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:
CH2CH3
F
H
CH3
I
Os ácidos carboxílicos são compostos orgânicos que apresentam o mais pronunciado caráter ácido, muito embora sejam considerados ácidos fracos. Quando em solução aquosa, liberam íon hidrônio ou hidroxônio, como a reação a seguir:
 Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Monocloro acético.
β-cloro butanóico.
γ-iodo pentanóico.
Propanóico.
Benzóico.
O reagente de Grignard é preparado pela reação de haletos orgânicos com magnésio metálico usando um solvente aprótico, geralmente o éter etílico. Quando adicionado a aldeídos e cetonas, reage atacando o grupamento carbonila, formando um álcool de cadeia carbônica maior. Sendo assim, qual o produto da reação entre o brometo de etilmagnésio com a propanona?
Acetal
Cetal
Cetona
Aldeído
Hemicetal
Os anidridos de ácidos carboxílicos são compostos que apresentam em sua estrutura química um átomo de oxigênio ligado a dois grupos carbonílicos com dois radicais orgânicos. Sobre os anidridos, marque a alternativa correta.
Os anidridos simétricos são nomeados pelo nome do ácido carboxílico correspondente.
A palavra anidrido significa com água.
Se as duas moléculas de ácido carboxílico que formam o anidrido forem iguais, o anidrido será chamado de assimétrico.
Se as duas moléculas de ácido carboxílico que formam o anidrido forem diferentes, o anidrido será chamado de simétrico.
Os anidridos mistos são nomeados mantendo o nome de apenas um ácido carboxílico.
Em toda reação química é necessário que aconteça a quebra de uma ligação para formação de outra substância. Essa quebra pode acontecer de duas formas: cisão homolítica e heterolítica. Sobre essas duas formas de quebra de ligação, marque a alternativa correta.
Na cisão heterolítica, o par de elétrons da ligação ficará com apenas uma das espécies.
Na cisão homolítica, o par de elétrons da ligação ficará com apenas um átomo que compõe a ligação.
Na cisão heterolítica, pode ocorrer a formação de espécies radicalares.
A cisão homolítica é mais comum de acontecer que a cisão heterolítica.
Na cisão heterolítica, o par de elétrons da ligação é dividido entre os átomos que compõe a ligação.
Conhecido por ser uma solução para emagrecer rapidamente a sibutramina é um fármaco utilizado no tratamento da obesidade. Classificado no grupo dos medicamentos inibidores seletivos da recaptação da serotonina e norepinefrina, é em outras palavras, um moderador de apetite que faz com que a pessoa não sinta fome e consuma menos calorias. A estrutura da sibutramina está representada a seguir e com base nessa estrutura, pode-se afirmar que:

É um ácido de Arrhenius, porque possui um átomo de nitrogênio capaz de doar próton.
É uma base de Lewis, porque possui um átomo de nitrogênio que pode receber um par de elétrons de um ácido.
É um ácido de Bronsted-Lowry, porque possui um átomo de nitrogênio terciário.
É um ácido de Lewis, porque possui um átomo de nitrogênio capaz de receber um par de elétrons de um ácido.
É uma base de Lewis, porque possui um átomo de nitrogênio que pode doar um par de elétrons para ácidos.
Os ácidos orgânicos e os fenóis possuem caráter ácido, ou seja, ionizam liberando íons H+ quando em solução aquosa. Mas quando comparados aos ácidos inorgânicos, são bem mais fracos. No entanto, a presença de determinados grupos ligados ao átomo de carbono, provoca um aumento na ionização do composto. Considere uma substância representada pela estrutura abaixo:
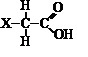 A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:
A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:
CH2CH3
F
H
CH3
I
Os ácidos carboxílicos são compostos orgânicos que apresentam o mais pronunciado caráter ácido, muito embora sejam considerados ácidos fracos. Quando em solução aquosa, liberam íon hidrônio ou hidroxônio, como a reação a seguir:
 Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Monocloro acético.
β-cloro butanóico.
γ-iodo pentanóico.
Propanóico.
Benzóico.
O reagente de Grignard é preparado pela reação de haletos orgânicos com magnésio metálico usando um solvente aprótico, geralmente o éter etílico. Quando adicionado a aldeídos e cetonas, reage atacando o grupamento carbonila, formando um álcool de cadeia carbônica maior. Sendo assim, qual o produto da reação entre o brometo de etilmagnésio com a propanona?
Os anidridos simétricos são nomeados pelo nome do ácido carboxílico correspondente.
A palavra anidrido significa com água.
Se as duas moléculas de ácido carboxílico que formam o anidrido forem iguais, o anidrido será chamado de assimétrico.
Se as duas moléculas de ácido carboxílico que formam o anidrido forem diferentes, o anidrido será chamado de simétrico.
Os anidridos mistos são nomeados mantendo o nome de apenas um ácido carboxílico.
Em toda reação química é necessário que aconteça a quebra de uma ligação para formação de outra substância. Essa quebra pode acontecer de duas formas: cisão homolítica e heterolítica. Sobre essas duas formas de quebra de ligação, marque a alternativa correta.
Na cisão heterolítica, o par de elétrons da ligação ficará com apenas uma das espécies.
Na cisão homolítica, o par de elétrons da ligação ficará com apenas um átomo que compõe a ligação.
Na cisão heterolítica, pode ocorrer a formação de espécies radicalares.
A cisão homolítica é mais comum de acontecer que a cisão heterolítica.
Na cisão heterolítica, o par de elétrons da ligação é dividido entre os átomos que compõe a ligação.
Conhecido por ser uma solução para emagrecer rapidamente a sibutramina é um fármaco utilizado no tratamento da obesidade. Classificado no grupo dos medicamentos inibidores seletivos da recaptação da serotonina e norepinefrina, é em outras palavras, um moderador de apetite que faz com que a pessoa não sinta fome e consuma menos calorias. A estrutura da sibutramina está representada a seguir e com base nessa estrutura, pode-se afirmar que:

É um ácido de Arrhenius, porque possui um átomo de nitrogênio capaz de doar próton.
É uma base de Lewis, porque possui um átomo de nitrogênio que pode receber um par de elétrons de um ácido.
É um ácido de Bronsted-Lowry, porque possui um átomo de nitrogênio terciário.
É um ácido de Lewis, porque possui um átomo de nitrogênio capaz de receber um par de elétrons de um ácido.
É uma base de Lewis, porque possui um átomo de nitrogênio que pode doar um par de elétrons para ácidos.
Os ácidos orgânicos e os fenóis possuem caráter ácido, ou seja, ionizam liberando íons H+ quando em solução aquosa. Mas quando comparados aos ácidos inorgânicos, são bem mais fracos. No entanto, a presença de determinados grupos ligados ao átomo de carbono, provoca um aumento na ionização do composto. Considere uma substância representada pela estrutura abaixo:
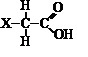 A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:
A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:
CH2CH3
F
H
CH3
I
Os ácidos carboxílicos são compostos orgânicos que apresentam o mais pronunciado caráter ácido, muito embora sejam considerados ácidos fracos. Quando em solução aquosa, liberam íon hidrônio ou hidroxônio, como a reação a seguir:
 Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Monocloro acético.
β-cloro butanóico.
γ-iodo pentanóico.
Propanóico.
Benzóico.
O reagente de Grignard é preparado pela reação de haletos orgânicos com magnésio metálico usando um solvente aprótico, geralmente o éter etílico. Quando adicionado a aldeídos e cetonas, reage atacando o grupamento carbonila, formando um álcool de cadeia carbônica maior. Sendo assim, qual o produto da reação entre o brometo de etilmagnésio com a propanona?
Na cisão heterolítica, o par de elétrons da ligação ficará com apenas uma das espécies.
Na cisão homolítica, o par de elétrons da ligação ficará com apenas um átomo que compõe a ligação.
Na cisão heterolítica, pode ocorrer a formação de espécies radicalares.
A cisão homolítica é mais comum de acontecer que a cisão heterolítica.
Na cisão heterolítica, o par de elétrons da ligação é dividido entre os átomos que compõe a ligação.
Conhecido por ser uma solução para emagrecer rapidamente a sibutramina é um fármaco utilizado no tratamento da obesidade. Classificado no grupo dos medicamentos inibidores seletivos da recaptação da serotonina e norepinefrina, é em outras palavras, um moderador de apetite que faz com que a pessoa não sinta fome e consuma menos calorias. A estrutura da sibutramina está representada a seguir e com base nessa estrutura, pode-se afirmar que:

É um ácido de Arrhenius, porque possui um átomo de nitrogênio capaz de doar próton.
É uma base de Lewis, porque possui um átomo de nitrogênio que pode receber um par de elétrons de um ácido.
É um ácido de Bronsted-Lowry, porque possui um átomo de nitrogênio terciário.
É um ácido de Lewis, porque possui um átomo de nitrogênio capaz de receber um par de elétrons de um ácido.
É uma base de Lewis, porque possui um átomo de nitrogênio que pode doar um par de elétrons para ácidos.
Os ácidos orgânicos e os fenóis possuem caráter ácido, ou seja, ionizam liberando íons H+ quando em solução aquosa. Mas quando comparados aos ácidos inorgânicos, são bem mais fracos. No entanto, a presença de determinados grupos ligados ao átomo de carbono, provoca um aumento na ionização do composto. Considere uma substância representada pela estrutura abaixo:
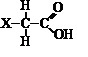 A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:
A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:
CH2CH3
F
H
CH3
I
Os ácidos carboxílicos são compostos orgânicos que apresentam o mais pronunciado caráter ácido, muito embora sejam considerados ácidos fracos. Quando em solução aquosa, liberam íon hidrônio ou hidroxônio, como a reação a seguir:
 Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Monocloro acético.
β-cloro butanóico.
γ-iodo pentanóico.
Propanóico.
Benzóico.
O reagente de Grignard é preparado pela reação de haletos orgânicos com magnésio metálico usando um solvente aprótico, geralmente o éter etílico. Quando adicionado a aldeídos e cetonas, reage atacando o grupamento carbonila, formando um álcool de cadeia carbônica maior. Sendo assim, qual o produto da reação entre o brometo de etilmagnésio com a propanona?

É um ácido de Arrhenius, porque possui um átomo de nitrogênio capaz de doar próton.
É uma base de Lewis, porque possui um átomo de nitrogênio que pode receber um par de elétrons de um ácido.
É um ácido de Bronsted-Lowry, porque possui um átomo de nitrogênio terciário.
É um ácido de Lewis, porque possui um átomo de nitrogênio capaz de receber um par de elétrons de um ácido.
É uma base de Lewis, porque possui um átomo de nitrogênio que pode doar um par de elétrons para ácidos.
Os ácidos orgânicos e os fenóis possuem caráter ácido, ou seja, ionizam liberando íons H+ quando em solução aquosa. Mas quando comparados aos ácidos inorgânicos, são bem mais fracos. No entanto, a presença de determinados grupos ligados ao átomo de carbono, provoca um aumento na ionização do composto. Considere uma substância representada pela estrutura abaixo:
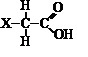 A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:
A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:
CH2CH3
F
H
CH3
I
Os ácidos carboxílicos são compostos orgânicos que apresentam o mais pronunciado caráter ácido, muito embora sejam considerados ácidos fracos. Quando em solução aquosa, liberam íon hidrônio ou hidroxônio, como a reação a seguir:
 Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Monocloro acético.
β-cloro butanóico.
γ-iodo pentanóico.
Propanóico.
Benzóico.
O reagente de Grignard é preparado pela reação de haletos orgânicos com magnésio metálico usando um solvente aprótico, geralmente o éter etílico. Quando adicionado a aldeídos e cetonas, reage atacando o grupamento carbonila, formando um álcool de cadeia carbônica maior. Sendo assim, qual o produto da reação entre o brometo de etilmagnésio com a propanona?
CH2CH3
F
H
CH3
I
Os ácidos carboxílicos são compostos orgânicos que apresentam o mais pronunciado caráter ácido, muito embora sejam considerados ácidos fracos. Quando em solução aquosa, liberam íon hidrônio ou hidroxônio, como a reação a seguir:
 Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Monocloro acético.
β-cloro butanóico.
γ-iodo pentanóico.
Propanóico.
Benzóico.
O reagente de Grignard é preparado pela reação de haletos orgânicos com magnésio metálico usando um solvente aprótico, geralmente o éter etílico. Quando adicionado a aldeídos e cetonas, reage atacando o grupamento carbonila, formando um álcool de cadeia carbônica maior. Sendo assim, qual o produto da reação entre o brometo de etilmagnésio com a propanona?
Monocloro acético.
β-cloro butanóico.
γ-iodo pentanóico.
Propanóico.
Benzóico.