QUÍMICA ANALÍTICA I
Os testes qualitativos são baseados em reações de neutralização, precipitação, complexação e oxirredução. São bem simples e os resultados obtidos oferecem informações rápidas, de baixo custo e com resultados criticamente confiáveis. A análise qualitativa de cátions pode ser dividida em grupos, devido a suas similaridades reacionais. Sendo assim, qual elemento não reage com ácido clorídrico, mas forma um precipitado colorido com ácido sulfídrico em meio ácido mineral diluído?
Sr2+
Mn2+
Ag+
Co2+
Cu2+
Na química analítica qualitativa, focamos, principalmente, no estudo de identificação de possíveis íons presentes nas mais diversas classes de matrizes amostrais. Os cátions analisados podem ser divididos em 5 grupos de acordo com as suas similaridades reacionais. Qual grupo de cátions formam precipitados com carbonato de amônio na presença de cloreto de amônio em meio neutro ou levemente alcalino?
Grupo II
Grupo V
Grupo IV
Grupo I
Grupo III
A força de doação de prótons de um ácido é medida pela sua constante de ionização ácida (Ka) e a força de aceitação de prótons de uma base é medida pela sua constante de ionização básica (Kb). Dê acordo com essa afirmação responda, calcule os valores de pKa e pKb para o composto H2CO3 (Ka = 4,3x10-7). Dados: Kw = 1x10-14.
pKa = 6,37 e pKb = 4,3x10-7
pKa = 7,02 e pKb = 13,98
pKa = 7,63 e pKb = 6,37
pKa = 4,3x10-7 e pKb = 6,37
pKa = 6,37 e pKb = 7,63
Em água, alguns ácidos são melhores doadores de prótons do que outros, enquanto que algumas bases são melhores aceptoras de prótons do que outras. Por exemplo, uma solução aquosa de HCl diluída, consiste, praticamente, de íons cloreto e hidrônio, uma vez que quase 100% das moléculas são ionizadas. Sendo assim, calcule o pH e pOH de uma solução de HCl 0,65 mol/L.
pH = 1,187 e pOH = 13,813
pH = 0,187 e pOH = 12,13
pH = 13,813 e pOH = 0,18
pH = 1,87 e pOH = 12,13
pH = 0,187 e pOH = 13,813
Uma solução tampão é aquela cujo pH se mantém praticamente invariável face à adição de pequenas quantidades de ácido ou base ou quando a solução é diluída. Foram adicionados 15 mL de uma solução 0,5 mol/L de KOH à uma solução-tampão formada por 0,15 mol/L de ácido acético com 0,15 mol/L de acetato de potássio. Calcule, respectivamente, o pH inicial da solução e o pH após a adição do hidróxido de potássio. Dados: Ka = 1,8x10-5.
9,26 e 9,22
4,86 e 4,97
4,74 e 4,78
4,74 e 5,74
9,14 e 9,53
Hidrólise é o processo químico em que ocorre a quebra de uma molécula por água. Tal processo pode ser observado tanto em compostos orgânicos como em compostos inorgânicos. A hidrólise salina é a reação entre um sal e a água, podendo provocar alterações de pH na solução final. Calcule o pH de uma solução 0,5 mol/L de (NH4)S. Dados: Ka H2S = 6,3x10-8 ; Kb NH4OH = 1,8x10-5 e Kw = 1x10-14.
5,8
9,1
10,4
7,0
3,6
A força de doação de prótons de um ácido é medida pela sua constante de ionização ácida (Ka), ou seja, quanto mais alto o valor de Ka, mais forte será o ácido. Calcule o pH de uma solução de ácido carbônio de concentração 0,2 mol/L. Dados Ka = 4,3x10-7.
6,93
3,53
7,06
0,7
10,46
Os indicadores ácido-base possuem várias aplicações no nosso cotidiano, tais como fitas indicadoras de pH de água de piscina e aquário, determinação de pH de fluídos biológicos e identificação de substâncias ácidas e básicas. Existem dois tipos de papel indicador: o tornassol e o universal. Sobre o papel de tornassol, marque a alternativa correta.
O tornassol vermelho muda para azul quando a solução é ácida.
O tornassol vermelho muda para azul quando a solução é básica.
O tornassol é um indicador natural.
O tornassol azul muda para vermelho quando a solução é ácida e para amarelo quando é básica.
O tornassol azul muda para vermelho quando a solução é básica.
No laboratório de uma escola de ensino médio, o professor realizou quatro experimentos, para os quais foi usado o equipamento mostrado na figura a seguir.
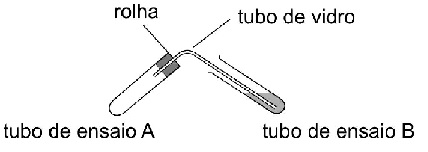
Dado: Nos quatro experimentos, o tubo B continha uma certa quantidade de água, uma tira de papel tornassol azul e uma tira de papel tornassol vermelho.
Experimento 1. No tubo de ensaio A, colocou-se uma certa quantidade de soluções aquosas de cloreto de amônio e de hidróxido de sódio, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B.
Experimento 2. No tubo de ensaio A, colocou-se uma certa quantidade de carbonato de cálcio sólido, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B. Em seguida, com o auxílio da chama de um bico de Bunsen, o tubo de ensaio A foi aquecido.
Experimento 3. No tubo de ensaio A, colocou-se um pedaço de cobre metálico e uma certa quantidade de ácido nítrico concentrado, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B.
Experimento 4. No tubo de ensaio A, colocou-se um pedaço de fio de magnésio, uma certa quantidade de solução diluída de ácido clorídrico, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B.
Considerando os produtos das reações dos experimentos 1, 2, 3 e 4, considere as afirmativas a seguir.
I. No experimento 1, o papel tornassol vermelho tornou-se azul e o papel tornassol azul não alterou a sua cor.
II. No experimento 2, o papel tornassol azul tornou-se vermelho e o papel tornassol vermelho não alterou sua cor.
III. No experimento 3, o papel tornassol vermelho tornou-se azul e o papel tornassol azul não alterou sua cor.
IV. No experimento 4, os papéis tornassol azul e vermelho mantiveram suas cores.
Assinale a alternativa correta.
Somente as afirmativas II e III são corretas.
Somente as afirmativas I, II e III são corretas.
Somente as afirmativas III e IV são corretas.
Somente as afirmativas I e IV são corretas.
Somente as afirmativas I, II e IV são corretas.
Os testes por via seca, como o próprio nome diz, são experimentos realizados com amostras, sem prévio tratamento com algumas soluções extratoras. As amostras normalmente reagem diretamente em chama com outras espécies químicas, formando, normalmente, um sal complexado de cores definidas. Existem três testes por via seca, que podem ser utilizados, apresentando resultados com um nível de confiabilidade razoável, são eles:
- Teste com pérola de Bórax;
- Teste com pérola de Fosfato;
- Teste com pérola de Carbonato.
Sobre esses três testes marque a alternativa que melhor descreve cada um dos testes.
A maior vantagem dos testes por via seca é que cada pérola preparada realiza vários testes qualitativos de amostras diferentes.
A pérola de carbonato pode ser preparada pela fusão do carbonato de sódio em fio de platina. Esse teste é o mais empregado em testes por via seca.
A preparação da pérola de fosfato é semelhante a pérola de bórax. A pérola de fosfato deve apresentar coloração opaca e tonalidade branca.
A pérola de Boráx deve ser incolor e translúcida, qualquer pérola formada, diferente dessas características, deve ter sido contaminada.
Uma vez preparada a pérola de Bórax, devemos então colocar o analito, normalmente na forma líquida, em contato com o Bórax e levar ao aquecimento.
Sr2+
Mn2+
Ag+
Co2+
Cu2+
Na química analítica qualitativa, focamos, principalmente, no estudo de identificação de possíveis íons presentes nas mais diversas classes de matrizes amostrais. Os cátions analisados podem ser divididos em 5 grupos de acordo com as suas similaridades reacionais. Qual grupo de cátions formam precipitados com carbonato de amônio na presença de cloreto de amônio em meio neutro ou levemente alcalino?
Grupo II
Grupo V
Grupo IV
Grupo I
Grupo III
A força de doação de prótons de um ácido é medida pela sua constante de ionização ácida (Ka) e a força de aceitação de prótons de uma base é medida pela sua constante de ionização básica (Kb). Dê acordo com essa afirmação responda, calcule os valores de pKa e pKb para o composto H2CO3 (Ka = 4,3x10-7). Dados: Kw = 1x10-14.
pKa = 6,37 e pKb = 4,3x10-7
pKa = 7,02 e pKb = 13,98
pKa = 7,63 e pKb = 6,37
pKa = 4,3x10-7 e pKb = 6,37
pKa = 6,37 e pKb = 7,63
Em água, alguns ácidos são melhores doadores de prótons do que outros, enquanto que algumas bases são melhores aceptoras de prótons do que outras. Por exemplo, uma solução aquosa de HCl diluída, consiste, praticamente, de íons cloreto e hidrônio, uma vez que quase 100% das moléculas são ionizadas. Sendo assim, calcule o pH e pOH de uma solução de HCl 0,65 mol/L.
pH = 1,187 e pOH = 13,813
pH = 0,187 e pOH = 12,13
pH = 13,813 e pOH = 0,18
pH = 1,87 e pOH = 12,13
pH = 0,187 e pOH = 13,813
Uma solução tampão é aquela cujo pH se mantém praticamente invariável face à adição de pequenas quantidades de ácido ou base ou quando a solução é diluída. Foram adicionados 15 mL de uma solução 0,5 mol/L de KOH à uma solução-tampão formada por 0,15 mol/L de ácido acético com 0,15 mol/L de acetato de potássio. Calcule, respectivamente, o pH inicial da solução e o pH após a adição do hidróxido de potássio. Dados: Ka = 1,8x10-5.
9,26 e 9,22
4,86 e 4,97
4,74 e 4,78
4,74 e 5,74
9,14 e 9,53
Hidrólise é o processo químico em que ocorre a quebra de uma molécula por água. Tal processo pode ser observado tanto em compostos orgânicos como em compostos inorgânicos. A hidrólise salina é a reação entre um sal e a água, podendo provocar alterações de pH na solução final. Calcule o pH de uma solução 0,5 mol/L de (NH4)S. Dados: Ka H2S = 6,3x10-8 ; Kb NH4OH = 1,8x10-5 e Kw = 1x10-14.
5,8
9,1
10,4
7,0
3,6
A força de doação de prótons de um ácido é medida pela sua constante de ionização ácida (Ka), ou seja, quanto mais alto o valor de Ka, mais forte será o ácido. Calcule o pH de uma solução de ácido carbônio de concentração 0,2 mol/L. Dados Ka = 4,3x10-7.
6,93
3,53
7,06
0,7
10,46
Os indicadores ácido-base possuem várias aplicações no nosso cotidiano, tais como fitas indicadoras de pH de água de piscina e aquário, determinação de pH de fluídos biológicos e identificação de substâncias ácidas e básicas. Existem dois tipos de papel indicador: o tornassol e o universal. Sobre o papel de tornassol, marque a alternativa correta.
O tornassol vermelho muda para azul quando a solução é ácida.
O tornassol vermelho muda para azul quando a solução é básica.
O tornassol é um indicador natural.
O tornassol azul muda para vermelho quando a solução é ácida e para amarelo quando é básica.
O tornassol azul muda para vermelho quando a solução é básica.
No laboratório de uma escola de ensino médio, o professor realizou quatro experimentos, para os quais foi usado o equipamento mostrado na figura a seguir.

Dado: Nos quatro experimentos, o tubo B continha uma certa quantidade de água, uma tira de papel tornassol azul e uma tira de papel tornassol vermelho.
Experimento 1. No tubo de ensaio A, colocou-se uma certa quantidade de soluções aquosas de cloreto de amônio e de hidróxido de sódio, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B.
Experimento 2. No tubo de ensaio A, colocou-se uma certa quantidade de carbonato de cálcio sólido, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B. Em seguida, com o auxílio da chama de um bico de Bunsen, o tubo de ensaio A foi aquecido.
Experimento 3. No tubo de ensaio A, colocou-se um pedaço de cobre metálico e uma certa quantidade de ácido nítrico concentrado, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B.
Experimento 4. No tubo de ensaio A, colocou-se um pedaço de fio de magnésio, uma certa quantidade de solução diluída de ácido clorídrico, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B.
Considerando os produtos das reações dos experimentos 1, 2, 3 e 4, considere as afirmativas a seguir.
I. No experimento 1, o papel tornassol vermelho tornou-se azul e o papel tornassol azul não alterou a sua cor.
II. No experimento 2, o papel tornassol azul tornou-se vermelho e o papel tornassol vermelho não alterou sua cor.
III. No experimento 3, o papel tornassol vermelho tornou-se azul e o papel tornassol azul não alterou sua cor.
IV. No experimento 4, os papéis tornassol azul e vermelho mantiveram suas cores.
Assinale a alternativa correta.
Somente as afirmativas II e III são corretas.
Somente as afirmativas I, II e III são corretas.
Somente as afirmativas III e IV são corretas.
Somente as afirmativas I e IV são corretas.
Somente as afirmativas I, II e IV são corretas.
Os testes por via seca, como o próprio nome diz, são experimentos realizados com amostras, sem prévio tratamento com algumas soluções extratoras. As amostras normalmente reagem diretamente em chama com outras espécies químicas, formando, normalmente, um sal complexado de cores definidas. Existem três testes por via seca, que podem ser utilizados, apresentando resultados com um nível de confiabilidade razoável, são eles:
- Teste com pérola de Bórax;
- Teste com pérola de Fosfato;
- Teste com pérola de Carbonato.
Sobre esses três testes marque a alternativa que melhor descreve cada um dos testes.
A maior vantagem dos testes por via seca é que cada pérola preparada realiza vários testes qualitativos de amostras diferentes.
A pérola de carbonato pode ser preparada pela fusão do carbonato de sódio em fio de platina. Esse teste é o mais empregado em testes por via seca.
A preparação da pérola de fosfato é semelhante a pérola de bórax. A pérola de fosfato deve apresentar coloração opaca e tonalidade branca.
A pérola de Boráx deve ser incolor e translúcida, qualquer pérola formada, diferente dessas características, deve ter sido contaminada.
Uma vez preparada a pérola de Bórax, devemos então colocar o analito, normalmente na forma líquida, em contato com o Bórax e levar ao aquecimento.
Grupo II
Grupo V
Grupo IV
Grupo I
Grupo III
A força de doação de prótons de um ácido é medida pela sua constante de ionização ácida (Ka) e a força de aceitação de prótons de uma base é medida pela sua constante de ionização básica (Kb). Dê acordo com essa afirmação responda, calcule os valores de pKa e pKb para o composto H2CO3 (Ka = 4,3x10-7). Dados: Kw = 1x10-14.
pKa = 6,37 e pKb = 4,3x10-7
pKa = 7,02 e pKb = 13,98
pKa = 7,63 e pKb = 6,37
pKa = 4,3x10-7 e pKb = 6,37
pKa = 6,37 e pKb = 7,63
Em água, alguns ácidos são melhores doadores de prótons do que outros, enquanto que algumas bases são melhores aceptoras de prótons do que outras. Por exemplo, uma solução aquosa de HCl diluída, consiste, praticamente, de íons cloreto e hidrônio, uma vez que quase 100% das moléculas são ionizadas. Sendo assim, calcule o pH e pOH de uma solução de HCl 0,65 mol/L.
pH = 1,187 e pOH = 13,813
pH = 0,187 e pOH = 12,13
pH = 13,813 e pOH = 0,18
pH = 1,87 e pOH = 12,13
pH = 0,187 e pOH = 13,813
Uma solução tampão é aquela cujo pH se mantém praticamente invariável face à adição de pequenas quantidades de ácido ou base ou quando a solução é diluída. Foram adicionados 15 mL de uma solução 0,5 mol/L de KOH à uma solução-tampão formada por 0,15 mol/L de ácido acético com 0,15 mol/L de acetato de potássio. Calcule, respectivamente, o pH inicial da solução e o pH após a adição do hidróxido de potássio. Dados: Ka = 1,8x10-5.
9,26 e 9,22
4,86 e 4,97
4,74 e 4,78
4,74 e 5,74
9,14 e 9,53
Hidrólise é o processo químico em que ocorre a quebra de uma molécula por água. Tal processo pode ser observado tanto em compostos orgânicos como em compostos inorgânicos. A hidrólise salina é a reação entre um sal e a água, podendo provocar alterações de pH na solução final. Calcule o pH de uma solução 0,5 mol/L de (NH4)S. Dados: Ka H2S = 6,3x10-8 ; Kb NH4OH = 1,8x10-5 e Kw = 1x10-14.
5,8
9,1
10,4
7,0
3,6
A força de doação de prótons de um ácido é medida pela sua constante de ionização ácida (Ka), ou seja, quanto mais alto o valor de Ka, mais forte será o ácido. Calcule o pH de uma solução de ácido carbônio de concentração 0,2 mol/L. Dados Ka = 4,3x10-7.
6,93
3,53
7,06
0,7
10,46
Os indicadores ácido-base possuem várias aplicações no nosso cotidiano, tais como fitas indicadoras de pH de água de piscina e aquário, determinação de pH de fluídos biológicos e identificação de substâncias ácidas e básicas. Existem dois tipos de papel indicador: o tornassol e o universal. Sobre o papel de tornassol, marque a alternativa correta.
O tornassol vermelho muda para azul quando a solução é ácida.
O tornassol vermelho muda para azul quando a solução é básica.
O tornassol é um indicador natural.
O tornassol azul muda para vermelho quando a solução é ácida e para amarelo quando é básica.
O tornassol azul muda para vermelho quando a solução é básica.
No laboratório de uma escola de ensino médio, o professor realizou quatro experimentos, para os quais foi usado o equipamento mostrado na figura a seguir.

Dado: Nos quatro experimentos, o tubo B continha uma certa quantidade de água, uma tira de papel tornassol azul e uma tira de papel tornassol vermelho.
Experimento 1. No tubo de ensaio A, colocou-se uma certa quantidade de soluções aquosas de cloreto de amônio e de hidróxido de sódio, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B.
Experimento 2. No tubo de ensaio A, colocou-se uma certa quantidade de carbonato de cálcio sólido, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B. Em seguida, com o auxílio da chama de um bico de Bunsen, o tubo de ensaio A foi aquecido.
Experimento 3. No tubo de ensaio A, colocou-se um pedaço de cobre metálico e uma certa quantidade de ácido nítrico concentrado, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B.
Experimento 4. No tubo de ensaio A, colocou-se um pedaço de fio de magnésio, uma certa quantidade de solução diluída de ácido clorídrico, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B.
Considerando os produtos das reações dos experimentos 1, 2, 3 e 4, considere as afirmativas a seguir.
I. No experimento 1, o papel tornassol vermelho tornou-se azul e o papel tornassol azul não alterou a sua cor.
II. No experimento 2, o papel tornassol azul tornou-se vermelho e o papel tornassol vermelho não alterou sua cor.
III. No experimento 3, o papel tornassol vermelho tornou-se azul e o papel tornassol azul não alterou sua cor.
IV. No experimento 4, os papéis tornassol azul e vermelho mantiveram suas cores.
Assinale a alternativa correta.
Somente as afirmativas II e III são corretas.
Somente as afirmativas I, II e III são corretas.
Somente as afirmativas III e IV são corretas.
Somente as afirmativas I e IV são corretas.
Somente as afirmativas I, II e IV são corretas.
Os testes por via seca, como o próprio nome diz, são experimentos realizados com amostras, sem prévio tratamento com algumas soluções extratoras. As amostras normalmente reagem diretamente em chama com outras espécies químicas, formando, normalmente, um sal complexado de cores definidas. Existem três testes por via seca, que podem ser utilizados, apresentando resultados com um nível de confiabilidade razoável, são eles:
- Teste com pérola de Bórax;
- Teste com pérola de Fosfato;
- Teste com pérola de Carbonato.
Sobre esses três testes marque a alternativa que melhor descreve cada um dos testes.
A maior vantagem dos testes por via seca é que cada pérola preparada realiza vários testes qualitativos de amostras diferentes.
A pérola de carbonato pode ser preparada pela fusão do carbonato de sódio em fio de platina. Esse teste é o mais empregado em testes por via seca.
A preparação da pérola de fosfato é semelhante a pérola de bórax. A pérola de fosfato deve apresentar coloração opaca e tonalidade branca.
A pérola de Boráx deve ser incolor e translúcida, qualquer pérola formada, diferente dessas características, deve ter sido contaminada.
Uma vez preparada a pérola de Bórax, devemos então colocar o analito, normalmente na forma líquida, em contato com o Bórax e levar ao aquecimento.
pKa = 6,37 e pKb = 4,3x10-7
pKa = 7,02 e pKb = 13,98
pKa = 7,63 e pKb = 6,37
pKa = 4,3x10-7 e pKb = 6,37
pKa = 6,37 e pKb = 7,63
Em água, alguns ácidos são melhores doadores de prótons do que outros, enquanto que algumas bases são melhores aceptoras de prótons do que outras. Por exemplo, uma solução aquosa de HCl diluída, consiste, praticamente, de íons cloreto e hidrônio, uma vez que quase 100% das moléculas são ionizadas. Sendo assim, calcule o pH e pOH de uma solução de HCl 0,65 mol/L.
pH = 1,187 e pOH = 13,813
pH = 0,187 e pOH = 12,13
pH = 13,813 e pOH = 0,18
pH = 1,87 e pOH = 12,13
pH = 0,187 e pOH = 13,813
Uma solução tampão é aquela cujo pH se mantém praticamente invariável face à adição de pequenas quantidades de ácido ou base ou quando a solução é diluída. Foram adicionados 15 mL de uma solução 0,5 mol/L de KOH à uma solução-tampão formada por 0,15 mol/L de ácido acético com 0,15 mol/L de acetato de potássio. Calcule, respectivamente, o pH inicial da solução e o pH após a adição do hidróxido de potássio. Dados: Ka = 1,8x10-5.
9,26 e 9,22
4,86 e 4,97
4,74 e 4,78
4,74 e 5,74
9,14 e 9,53
Hidrólise é o processo químico em que ocorre a quebra de uma molécula por água. Tal processo pode ser observado tanto em compostos orgânicos como em compostos inorgânicos. A hidrólise salina é a reação entre um sal e a água, podendo provocar alterações de pH na solução final. Calcule o pH de uma solução 0,5 mol/L de (NH4)S. Dados: Ka H2S = 6,3x10-8 ; Kb NH4OH = 1,8x10-5 e Kw = 1x10-14.
5,8
9,1
10,4
7,0
3,6
A força de doação de prótons de um ácido é medida pela sua constante de ionização ácida (Ka), ou seja, quanto mais alto o valor de Ka, mais forte será o ácido. Calcule o pH de uma solução de ácido carbônio de concentração 0,2 mol/L. Dados Ka = 4,3x10-7.
6,93
3,53
7,06
0,7
10,46
Os indicadores ácido-base possuem várias aplicações no nosso cotidiano, tais como fitas indicadoras de pH de água de piscina e aquário, determinação de pH de fluídos biológicos e identificação de substâncias ácidas e básicas. Existem dois tipos de papel indicador: o tornassol e o universal. Sobre o papel de tornassol, marque a alternativa correta.
O tornassol vermelho muda para azul quando a solução é ácida.
O tornassol vermelho muda para azul quando a solução é básica.
O tornassol é um indicador natural.
O tornassol azul muda para vermelho quando a solução é ácida e para amarelo quando é básica.
O tornassol azul muda para vermelho quando a solução é básica.
No laboratório de uma escola de ensino médio, o professor realizou quatro experimentos, para os quais foi usado o equipamento mostrado na figura a seguir.

Dado: Nos quatro experimentos, o tubo B continha uma certa quantidade de água, uma tira de papel tornassol azul e uma tira de papel tornassol vermelho.
Experimento 1. No tubo de ensaio A, colocou-se uma certa quantidade de soluções aquosas de cloreto de amônio e de hidróxido de sódio, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B.
Experimento 2. No tubo de ensaio A, colocou-se uma certa quantidade de carbonato de cálcio sólido, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B. Em seguida, com o auxílio da chama de um bico de Bunsen, o tubo de ensaio A foi aquecido.
Experimento 3. No tubo de ensaio A, colocou-se um pedaço de cobre metálico e uma certa quantidade de ácido nítrico concentrado, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B.
Experimento 4. No tubo de ensaio A, colocou-se um pedaço de fio de magnésio, uma certa quantidade de solução diluída de ácido clorídrico, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B.
Considerando os produtos das reações dos experimentos 1, 2, 3 e 4, considere as afirmativas a seguir.
I. No experimento 1, o papel tornassol vermelho tornou-se azul e o papel tornassol azul não alterou a sua cor.
II. No experimento 2, o papel tornassol azul tornou-se vermelho e o papel tornassol vermelho não alterou sua cor.
III. No experimento 3, o papel tornassol vermelho tornou-se azul e o papel tornassol azul não alterou sua cor.
IV. No experimento 4, os papéis tornassol azul e vermelho mantiveram suas cores.
Assinale a alternativa correta.
Somente as afirmativas II e III são corretas.
Somente as afirmativas I, II e III são corretas.
Somente as afirmativas III e IV são corretas.
Somente as afirmativas I e IV são corretas.
Somente as afirmativas I, II e IV são corretas.
Os testes por via seca, como o próprio nome diz, são experimentos realizados com amostras, sem prévio tratamento com algumas soluções extratoras. As amostras normalmente reagem diretamente em chama com outras espécies químicas, formando, normalmente, um sal complexado de cores definidas. Existem três testes por via seca, que podem ser utilizados, apresentando resultados com um nível de confiabilidade razoável, são eles:
- Teste com pérola de Bórax;
- Teste com pérola de Fosfato;
- Teste com pérola de Carbonato.
Sobre esses três testes marque a alternativa que melhor descreve cada um dos testes.
A maior vantagem dos testes por via seca é que cada pérola preparada realiza vários testes qualitativos de amostras diferentes.
A pérola de carbonato pode ser preparada pela fusão do carbonato de sódio em fio de platina. Esse teste é o mais empregado em testes por via seca.
A preparação da pérola de fosfato é semelhante a pérola de bórax. A pérola de fosfato deve apresentar coloração opaca e tonalidade branca.
A pérola de Boráx deve ser incolor e translúcida, qualquer pérola formada, diferente dessas características, deve ter sido contaminada.
Uma vez preparada a pérola de Bórax, devemos então colocar o analito, normalmente na forma líquida, em contato com o Bórax e levar ao aquecimento.
pH = 1,187 e pOH = 13,813
pH = 0,187 e pOH = 12,13
pH = 13,813 e pOH = 0,18
pH = 1,87 e pOH = 12,13
pH = 0,187 e pOH = 13,813
Uma solução tampão é aquela cujo pH se mantém praticamente invariável face à adição de pequenas quantidades de ácido ou base ou quando a solução é diluída. Foram adicionados 15 mL de uma solução 0,5 mol/L de KOH à uma solução-tampão formada por 0,15 mol/L de ácido acético com 0,15 mol/L de acetato de potássio. Calcule, respectivamente, o pH inicial da solução e o pH após a adição do hidróxido de potássio. Dados: Ka = 1,8x10-5.
9,26 e 9,22
4,86 e 4,97
4,74 e 4,78
4,74 e 5,74
9,14 e 9,53
Hidrólise é o processo químico em que ocorre a quebra de uma molécula por água. Tal processo pode ser observado tanto em compostos orgânicos como em compostos inorgânicos. A hidrólise salina é a reação entre um sal e a água, podendo provocar alterações de pH na solução final. Calcule o pH de uma solução 0,5 mol/L de (NH4)S. Dados: Ka H2S = 6,3x10-8 ; Kb NH4OH = 1,8x10-5 e Kw = 1x10-14.
5,8
9,1
10,4
7,0
3,6
A força de doação de prótons de um ácido é medida pela sua constante de ionização ácida (Ka), ou seja, quanto mais alto o valor de Ka, mais forte será o ácido. Calcule o pH de uma solução de ácido carbônio de concentração 0,2 mol/L. Dados Ka = 4,3x10-7.
6,93
3,53
7,06
0,7
10,46
Os indicadores ácido-base possuem várias aplicações no nosso cotidiano, tais como fitas indicadoras de pH de água de piscina e aquário, determinação de pH de fluídos biológicos e identificação de substâncias ácidas e básicas. Existem dois tipos de papel indicador: o tornassol e o universal. Sobre o papel de tornassol, marque a alternativa correta.
O tornassol vermelho muda para azul quando a solução é ácida.
O tornassol vermelho muda para azul quando a solução é básica.
O tornassol é um indicador natural.
O tornassol azul muda para vermelho quando a solução é ácida e para amarelo quando é básica.
O tornassol azul muda para vermelho quando a solução é básica.
No laboratório de uma escola de ensino médio, o professor realizou quatro experimentos, para os quais foi usado o equipamento mostrado na figura a seguir.

Dado: Nos quatro experimentos, o tubo B continha uma certa quantidade de água, uma tira de papel tornassol azul e uma tira de papel tornassol vermelho.
Experimento 1. No tubo de ensaio A, colocou-se uma certa quantidade de soluções aquosas de cloreto de amônio e de hidróxido de sódio, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B.
Experimento 2. No tubo de ensaio A, colocou-se uma certa quantidade de carbonato de cálcio sólido, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B. Em seguida, com o auxílio da chama de um bico de Bunsen, o tubo de ensaio A foi aquecido.
Experimento 3. No tubo de ensaio A, colocou-se um pedaço de cobre metálico e uma certa quantidade de ácido nítrico concentrado, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B.
Experimento 4. No tubo de ensaio A, colocou-se um pedaço de fio de magnésio, uma certa quantidade de solução diluída de ácido clorídrico, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B.
Considerando os produtos das reações dos experimentos 1, 2, 3 e 4, considere as afirmativas a seguir.
I. No experimento 1, o papel tornassol vermelho tornou-se azul e o papel tornassol azul não alterou a sua cor.
II. No experimento 2, o papel tornassol azul tornou-se vermelho e o papel tornassol vermelho não alterou sua cor.
III. No experimento 3, o papel tornassol vermelho tornou-se azul e o papel tornassol azul não alterou sua cor.
IV. No experimento 4, os papéis tornassol azul e vermelho mantiveram suas cores.
Assinale a alternativa correta.
Somente as afirmativas II e III são corretas.
Somente as afirmativas I, II e III são corretas.
Somente as afirmativas III e IV são corretas.
Somente as afirmativas I e IV são corretas.
Somente as afirmativas I, II e IV são corretas.
Os testes por via seca, como o próprio nome diz, são experimentos realizados com amostras, sem prévio tratamento com algumas soluções extratoras. As amostras normalmente reagem diretamente em chama com outras espécies químicas, formando, normalmente, um sal complexado de cores definidas. Existem três testes por via seca, que podem ser utilizados, apresentando resultados com um nível de confiabilidade razoável, são eles:
- Teste com pérola de Bórax;
- Teste com pérola de Fosfato;
- Teste com pérola de Carbonato.
Sobre esses três testes marque a alternativa que melhor descreve cada um dos testes.
A maior vantagem dos testes por via seca é que cada pérola preparada realiza vários testes qualitativos de amostras diferentes.
A pérola de carbonato pode ser preparada pela fusão do carbonato de sódio em fio de platina. Esse teste é o mais empregado em testes por via seca.
A preparação da pérola de fosfato é semelhante a pérola de bórax. A pérola de fosfato deve apresentar coloração opaca e tonalidade branca.
A pérola de Boráx deve ser incolor e translúcida, qualquer pérola formada, diferente dessas características, deve ter sido contaminada.
Uma vez preparada a pérola de Bórax, devemos então colocar o analito, normalmente na forma líquida, em contato com o Bórax e levar ao aquecimento.
9,26 e 9,22
4,86 e 4,97
4,74 e 4,78
4,74 e 5,74
9,14 e 9,53
Hidrólise é o processo químico em que ocorre a quebra de uma molécula por água. Tal processo pode ser observado tanto em compostos orgânicos como em compostos inorgânicos. A hidrólise salina é a reação entre um sal e a água, podendo provocar alterações de pH na solução final. Calcule o pH de uma solução 0,5 mol/L de (NH4)S. Dados: Ka H2S = 6,3x10-8 ; Kb NH4OH = 1,8x10-5 e Kw = 1x10-14.
5,8
9,1
10,4
7,0
3,6
A força de doação de prótons de um ácido é medida pela sua constante de ionização ácida (Ka), ou seja, quanto mais alto o valor de Ka, mais forte será o ácido. Calcule o pH de uma solução de ácido carbônio de concentração 0,2 mol/L. Dados Ka = 4,3x10-7.
6,93
3,53
7,06
0,7
10,46
Os indicadores ácido-base possuem várias aplicações no nosso cotidiano, tais como fitas indicadoras de pH de água de piscina e aquário, determinação de pH de fluídos biológicos e identificação de substâncias ácidas e básicas. Existem dois tipos de papel indicador: o tornassol e o universal. Sobre o papel de tornassol, marque a alternativa correta.
O tornassol vermelho muda para azul quando a solução é ácida.
O tornassol vermelho muda para azul quando a solução é básica.
O tornassol é um indicador natural.
O tornassol azul muda para vermelho quando a solução é ácida e para amarelo quando é básica.
O tornassol azul muda para vermelho quando a solução é básica.
No laboratório de uma escola de ensino médio, o professor realizou quatro experimentos, para os quais foi usado o equipamento mostrado na figura a seguir.

Dado: Nos quatro experimentos, o tubo B continha uma certa quantidade de água, uma tira de papel tornassol azul e uma tira de papel tornassol vermelho.
Experimento 1. No tubo de ensaio A, colocou-se uma certa quantidade de soluções aquosas de cloreto de amônio e de hidróxido de sódio, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B.
Experimento 2. No tubo de ensaio A, colocou-se uma certa quantidade de carbonato de cálcio sólido, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B. Em seguida, com o auxílio da chama de um bico de Bunsen, o tubo de ensaio A foi aquecido.
Experimento 3. No tubo de ensaio A, colocou-se um pedaço de cobre metálico e uma certa quantidade de ácido nítrico concentrado, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B.
Experimento 4. No tubo de ensaio A, colocou-se um pedaço de fio de magnésio, uma certa quantidade de solução diluída de ácido clorídrico, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B.
Considerando os produtos das reações dos experimentos 1, 2, 3 e 4, considere as afirmativas a seguir.
I. No experimento 1, o papel tornassol vermelho tornou-se azul e o papel tornassol azul não alterou a sua cor.
II. No experimento 2, o papel tornassol azul tornou-se vermelho e o papel tornassol vermelho não alterou sua cor.
III. No experimento 3, o papel tornassol vermelho tornou-se azul e o papel tornassol azul não alterou sua cor.
IV. No experimento 4, os papéis tornassol azul e vermelho mantiveram suas cores.
Assinale a alternativa correta.
Somente as afirmativas II e III são corretas.
Somente as afirmativas I, II e III são corretas.
Somente as afirmativas III e IV são corretas.
Somente as afirmativas I e IV são corretas.
Somente as afirmativas I, II e IV são corretas.
Os testes por via seca, como o próprio nome diz, são experimentos realizados com amostras, sem prévio tratamento com algumas soluções extratoras. As amostras normalmente reagem diretamente em chama com outras espécies químicas, formando, normalmente, um sal complexado de cores definidas. Existem três testes por via seca, que podem ser utilizados, apresentando resultados com um nível de confiabilidade razoável, são eles:
- Teste com pérola de Bórax;
- Teste com pérola de Fosfato;
- Teste com pérola de Carbonato.
Sobre esses três testes marque a alternativa que melhor descreve cada um dos testes.
A maior vantagem dos testes por via seca é que cada pérola preparada realiza vários testes qualitativos de amostras diferentes.
A pérola de carbonato pode ser preparada pela fusão do carbonato de sódio em fio de platina. Esse teste é o mais empregado em testes por via seca.
A preparação da pérola de fosfato é semelhante a pérola de bórax. A pérola de fosfato deve apresentar coloração opaca e tonalidade branca.
A pérola de Boráx deve ser incolor e translúcida, qualquer pérola formada, diferente dessas características, deve ter sido contaminada.
Uma vez preparada a pérola de Bórax, devemos então colocar o analito, normalmente na forma líquida, em contato com o Bórax e levar ao aquecimento.
5,8
9,1
10,4
7,0
3,6
A força de doação de prótons de um ácido é medida pela sua constante de ionização ácida (Ka), ou seja, quanto mais alto o valor de Ka, mais forte será o ácido. Calcule o pH de uma solução de ácido carbônio de concentração 0,2 mol/L. Dados Ka = 4,3x10-7.
6,93
3,53
7,06
0,7
10,46
Os indicadores ácido-base possuem várias aplicações no nosso cotidiano, tais como fitas indicadoras de pH de água de piscina e aquário, determinação de pH de fluídos biológicos e identificação de substâncias ácidas e básicas. Existem dois tipos de papel indicador: o tornassol e o universal. Sobre o papel de tornassol, marque a alternativa correta.
O tornassol vermelho muda para azul quando a solução é ácida.
O tornassol vermelho muda para azul quando a solução é básica.
O tornassol é um indicador natural.
O tornassol azul muda para vermelho quando a solução é ácida e para amarelo quando é básica.
O tornassol azul muda para vermelho quando a solução é básica.
No laboratório de uma escola de ensino médio, o professor realizou quatro experimentos, para os quais foi usado o equipamento mostrado na figura a seguir.

Dado: Nos quatro experimentos, o tubo B continha uma certa quantidade de água, uma tira de papel tornassol azul e uma tira de papel tornassol vermelho.
Experimento 1. No tubo de ensaio A, colocou-se uma certa quantidade de soluções aquosas de cloreto de amônio e de hidróxido de sódio, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B.
Experimento 2. No tubo de ensaio A, colocou-se uma certa quantidade de carbonato de cálcio sólido, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B. Em seguida, com o auxílio da chama de um bico de Bunsen, o tubo de ensaio A foi aquecido.
Experimento 3. No tubo de ensaio A, colocou-se um pedaço de cobre metálico e uma certa quantidade de ácido nítrico concentrado, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B.
Experimento 4. No tubo de ensaio A, colocou-se um pedaço de fio de magnésio, uma certa quantidade de solução diluída de ácido clorídrico, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B.
Considerando os produtos das reações dos experimentos 1, 2, 3 e 4, considere as afirmativas a seguir.
I. No experimento 1, o papel tornassol vermelho tornou-se azul e o papel tornassol azul não alterou a sua cor.
II. No experimento 2, o papel tornassol azul tornou-se vermelho e o papel tornassol vermelho não alterou sua cor.
III. No experimento 3, o papel tornassol vermelho tornou-se azul e o papel tornassol azul não alterou sua cor.
IV. No experimento 4, os papéis tornassol azul e vermelho mantiveram suas cores.
Assinale a alternativa correta.
Somente as afirmativas II e III são corretas.
Somente as afirmativas I, II e III são corretas.
Somente as afirmativas III e IV são corretas.
Somente as afirmativas I e IV são corretas.
Somente as afirmativas I, II e IV são corretas.
Os testes por via seca, como o próprio nome diz, são experimentos realizados com amostras, sem prévio tratamento com algumas soluções extratoras. As amostras normalmente reagem diretamente em chama com outras espécies químicas, formando, normalmente, um sal complexado de cores definidas. Existem três testes por via seca, que podem ser utilizados, apresentando resultados com um nível de confiabilidade razoável, são eles:
- Teste com pérola de Bórax;
- Teste com pérola de Fosfato;
- Teste com pérola de Carbonato.
Sobre esses três testes marque a alternativa que melhor descreve cada um dos testes.
A maior vantagem dos testes por via seca é que cada pérola preparada realiza vários testes qualitativos de amostras diferentes.
A pérola de carbonato pode ser preparada pela fusão do carbonato de sódio em fio de platina. Esse teste é o mais empregado em testes por via seca.
A preparação da pérola de fosfato é semelhante a pérola de bórax. A pérola de fosfato deve apresentar coloração opaca e tonalidade branca.
A pérola de Boráx deve ser incolor e translúcida, qualquer pérola formada, diferente dessas características, deve ter sido contaminada.
Uma vez preparada a pérola de Bórax, devemos então colocar o analito, normalmente na forma líquida, em contato com o Bórax e levar ao aquecimento.
6,93
3,53
7,06
0,7
10,46
Os indicadores ácido-base possuem várias aplicações no nosso cotidiano, tais como fitas indicadoras de pH de água de piscina e aquário, determinação de pH de fluídos biológicos e identificação de substâncias ácidas e básicas. Existem dois tipos de papel indicador: o tornassol e o universal. Sobre o papel de tornassol, marque a alternativa correta.
O tornassol vermelho muda para azul quando a solução é ácida.
O tornassol vermelho muda para azul quando a solução é básica.
O tornassol é um indicador natural.
O tornassol azul muda para vermelho quando a solução é ácida e para amarelo quando é básica.
O tornassol azul muda para vermelho quando a solução é básica.
No laboratório de uma escola de ensino médio, o professor realizou quatro experimentos, para os quais foi usado o equipamento mostrado na figura a seguir.

Dado: Nos quatro experimentos, o tubo B continha uma certa quantidade de água, uma tira de papel tornassol azul e uma tira de papel tornassol vermelho.
Experimento 1. No tubo de ensaio A, colocou-se uma certa quantidade de soluções aquosas de cloreto de amônio e de hidróxido de sódio, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B.
Experimento 2. No tubo de ensaio A, colocou-se uma certa quantidade de carbonato de cálcio sólido, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B. Em seguida, com o auxílio da chama de um bico de Bunsen, o tubo de ensaio A foi aquecido.
Experimento 3. No tubo de ensaio A, colocou-se um pedaço de cobre metálico e uma certa quantidade de ácido nítrico concentrado, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B.
Experimento 4. No tubo de ensaio A, colocou-se um pedaço de fio de magnésio, uma certa quantidade de solução diluída de ácido clorídrico, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B.
Considerando os produtos das reações dos experimentos 1, 2, 3 e 4, considere as afirmativas a seguir.
I. No experimento 1, o papel tornassol vermelho tornou-se azul e o papel tornassol azul não alterou a sua cor.
II. No experimento 2, o papel tornassol azul tornou-se vermelho e o papel tornassol vermelho não alterou sua cor.
III. No experimento 3, o papel tornassol vermelho tornou-se azul e o papel tornassol azul não alterou sua cor.
IV. No experimento 4, os papéis tornassol azul e vermelho mantiveram suas cores.
Assinale a alternativa correta.
Somente as afirmativas II e III são corretas.
Somente as afirmativas I, II e III são corretas.
Somente as afirmativas III e IV são corretas.
Somente as afirmativas I e IV são corretas.
Somente as afirmativas I, II e IV são corretas.
Os testes por via seca, como o próprio nome diz, são experimentos realizados com amostras, sem prévio tratamento com algumas soluções extratoras. As amostras normalmente reagem diretamente em chama com outras espécies químicas, formando, normalmente, um sal complexado de cores definidas. Existem três testes por via seca, que podem ser utilizados, apresentando resultados com um nível de confiabilidade razoável, são eles:
- Teste com pérola de Bórax;
- Teste com pérola de Fosfato;
- Teste com pérola de Carbonato.
Sobre esses três testes marque a alternativa que melhor descreve cada um dos testes.
A maior vantagem dos testes por via seca é que cada pérola preparada realiza vários testes qualitativos de amostras diferentes.
A pérola de carbonato pode ser preparada pela fusão do carbonato de sódio em fio de platina. Esse teste é o mais empregado em testes por via seca.
A preparação da pérola de fosfato é semelhante a pérola de bórax. A pérola de fosfato deve apresentar coloração opaca e tonalidade branca.
A pérola de Boráx deve ser incolor e translúcida, qualquer pérola formada, diferente dessas características, deve ter sido contaminada.
Uma vez preparada a pérola de Bórax, devemos então colocar o analito, normalmente na forma líquida, em contato com o Bórax e levar ao aquecimento.
O tornassol vermelho muda para azul quando a solução é ácida.
O tornassol vermelho muda para azul quando a solução é básica.
O tornassol é um indicador natural.
O tornassol azul muda para vermelho quando a solução é ácida e para amarelo quando é básica.
O tornassol azul muda para vermelho quando a solução é básica.
No laboratório de uma escola de ensino médio, o professor realizou quatro experimentos, para os quais foi usado o equipamento mostrado na figura a seguir.

Dado: Nos quatro experimentos, o tubo B continha uma certa quantidade de água, uma tira de papel tornassol azul e uma tira de papel tornassol vermelho.
Experimento 1. No tubo de ensaio A, colocou-se uma certa quantidade de soluções aquosas de cloreto de amônio e de hidróxido de sódio, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B.
Experimento 2. No tubo de ensaio A, colocou-se uma certa quantidade de carbonato de cálcio sólido, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B. Em seguida, com o auxílio da chama de um bico de Bunsen, o tubo de ensaio A foi aquecido.
Experimento 3. No tubo de ensaio A, colocou-se um pedaço de cobre metálico e uma certa quantidade de ácido nítrico concentrado, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B.
Experimento 4. No tubo de ensaio A, colocou-se um pedaço de fio de magnésio, uma certa quantidade de solução diluída de ácido clorídrico, e este foi tampado. Mergulhou-se a outra extremidade do tubo de vidro no tubo de ensaio B.
Considerando os produtos das reações dos experimentos 1, 2, 3 e 4, considere as afirmativas a seguir.
I. No experimento 1, o papel tornassol vermelho tornou-se azul e o papel tornassol azul não alterou a sua cor.
II. No experimento 2, o papel tornassol azul tornou-se vermelho e o papel tornassol vermelho não alterou sua cor.
III. No experimento 3, o papel tornassol vermelho tornou-se azul e o papel tornassol azul não alterou sua cor.
IV. No experimento 4, os papéis tornassol azul e vermelho mantiveram suas cores.
Assinale a alternativa correta.
Somente as afirmativas II e III são corretas.
Somente as afirmativas I, II e III são corretas.
Somente as afirmativas III e IV são corretas.
Somente as afirmativas I e IV são corretas.
Somente as afirmativas I, II e IV são corretas.
Os testes por via seca, como o próprio nome diz, são experimentos realizados com amostras, sem prévio tratamento com algumas soluções extratoras. As amostras normalmente reagem diretamente em chama com outras espécies químicas, formando, normalmente, um sal complexado de cores definidas. Existem três testes por via seca, que podem ser utilizados, apresentando resultados com um nível de confiabilidade razoável, são eles:
- Teste com pérola de Bórax;
- Teste com pérola de Fosfato;
- Teste com pérola de Carbonato.
Sobre esses três testes marque a alternativa que melhor descreve cada um dos testes.
A maior vantagem dos testes por via seca é que cada pérola preparada realiza vários testes qualitativos de amostras diferentes.
A pérola de carbonato pode ser preparada pela fusão do carbonato de sódio em fio de platina. Esse teste é o mais empregado em testes por via seca.
A preparação da pérola de fosfato é semelhante a pérola de bórax. A pérola de fosfato deve apresentar coloração opaca e tonalidade branca.
A pérola de Boráx deve ser incolor e translúcida, qualquer pérola formada, diferente dessas características, deve ter sido contaminada.
Uma vez preparada a pérola de Bórax, devemos então colocar o analito, normalmente na forma líquida, em contato com o Bórax e levar ao aquecimento.
Somente as afirmativas II e III são corretas.
Somente as afirmativas I, II e III são corretas.
Somente as afirmativas III e IV são corretas.
Somente as afirmativas I e IV são corretas.
Somente as afirmativas I, II e IV são corretas.
Os testes por via seca, como o próprio nome diz, são experimentos realizados com amostras, sem prévio tratamento com algumas soluções extratoras. As amostras normalmente reagem diretamente em chama com outras espécies químicas, formando, normalmente, um sal complexado de cores definidas. Existem três testes por via seca, que podem ser utilizados, apresentando resultados com um nível de confiabilidade razoável, são eles:
- Teste com pérola de Bórax;
- Teste com pérola de Fosfato;
- Teste com pérola de Carbonato.
Sobre esses três testes marque a alternativa que melhor descreve cada um dos testes.
A maior vantagem dos testes por via seca é que cada pérola preparada realiza vários testes qualitativos de amostras diferentes.
A pérola de carbonato pode ser preparada pela fusão do carbonato de sódio em fio de platina. Esse teste é o mais empregado em testes por via seca.
A preparação da pérola de fosfato é semelhante a pérola de bórax. A pérola de fosfato deve apresentar coloração opaca e tonalidade branca.
A pérola de Boráx deve ser incolor e translúcida, qualquer pérola formada, diferente dessas características, deve ter sido contaminada.
Uma vez preparada a pérola de Bórax, devemos então colocar o analito, normalmente na forma líquida, em contato com o Bórax e levar ao aquecimento.
A maior vantagem dos testes por via seca é que cada pérola preparada realiza vários testes qualitativos de amostras diferentes.
A pérola de carbonato pode ser preparada pela fusão do carbonato de sódio em fio de platina. Esse teste é o mais empregado em testes por via seca.
A preparação da pérola de fosfato é semelhante a pérola de bórax. A pérola de fosfato deve apresentar coloração opaca e tonalidade branca.
A pérola de Boráx deve ser incolor e translúcida, qualquer pérola formada, diferente dessas características, deve ter sido contaminada.
Uma vez preparada a pérola de Bórax, devemos então colocar o analito, normalmente na forma líquida, em contato com o Bórax e levar ao aquecimento.