FÍSICO-QUÍMICA II
A velocidade de uma reação poderá ser obtida medindo-se a quantidade consumida de um reagente ou a quantidade de um produto que se forma em um determinado intervalo de tempo. A decomposição da água oxigenada pela equação: 2H2O2(aq) --> 2H2O(l) + O2(g). Considerando que inicialmente, tem-se uma H2O2 a uma concentração de 0,8 mol/L e após 10 minutos, a concentração de H2O2 é de 0,5 mol/L, calcule a velocidade média de decomposição da água oxigenada.
0,015 mol/L.mim
0,06 mol/L.mim
0,03 mol/L.mim
0,06 mol/L.s
0,03 mol/L.s
Ao realizar a reação de formação da água a partir dos gases hidrogênio (H2) e oxigênio (O2), verificou-se que a velocidade de consumo de oxigênio foi de 4 mol/min. Determine a velocidade de consumo de hidrogênio.
2H2 + O2 à2H2O
1 mol/mim
10 mol/mim
8 mol/mim
4 mol/mim
2 mol/mim
Analisando a reação reversível abaixo, quando se estabelece o equilíbrio químico é possível afirmar que: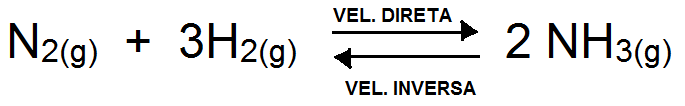
Vel. direta < Vel. inversa.
[N2] = [H2].
[NH3] = constante.
Vel. direta > Vel. inversa.
[N2] = [NH3].
Antes da utilização de câmeras digitais ser tão comum, a revelação de uma imagem fotográfica em um filme dependia da cinética química da redução do halogeneto de prata por um revelador. A tabela abaixo mostra o tempo de revelação de determinado filme usando um revelador D-76.
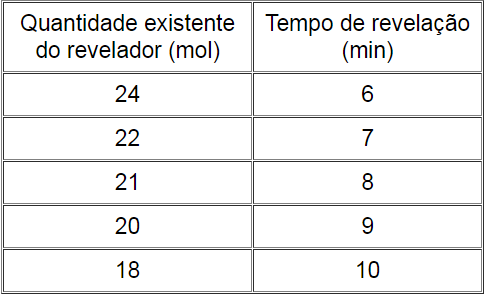
A velocidade média de revelação no intervalo de tempo de 7 min a 10 min é, em mol/min:
2,62
1,33
0,70
3,14
1,80
Um dos processos bastante comuns na industria de semi-jóias, é o banho de ouro. Em um desses processos, uma solução aquosa de cloreto de ouro (AuCl3) foi submetida à eletrólise durante 30min. Sabendo que a constante de Faraday igual a 96.500 C e a fórmula Q = i . t, assinale a alternativa que apresenta a corrente (i) em amperes, aplicada na célula para se obter 197 mg de ouro.
i = 0,100 A.
i = 2,06 A.
i = 0,38 A.
i = 0,16 A.
i = 0,05 A.
A produção do alumínio ocorre à partir da alumina (Al2O3) fundida, durante um processo de eletrólise. Nela, o íon Al+3 é reduzido, no cátodo, a Al. Imagine uma célula eletrolítica funcionando por 30h, na qual circulou uma corrente de 50 A (constante de Faraday = 96500 C). Assinale a alternativa que contém a massa correta de Al depositada.
1512 g
140 g
380 g
19 g
504 g
Durante um processo químico, ocorre eletrólise de uma solução de sulfato cúprico, com a seguinte redução catódica:
Cu2+(aq) + 2e- → Cu(s)
Quantos mols de íons de Cu2+(aq) são reduzidos por uma quantidade de eletricidade igual a 1,0 faraday?
2,5
1,0
2,0
1,5
0,50
Em um laboratório, um técnico monta uma pilha-padrão formada por Cu/Cu(NO3)2 e Fe/FeSO4 apresenta um potencial (ddp) igual a 0,78 volt. Conhecendo-se o potencial-padrão de redução de Cu2+ + 2 e – ----> Cu , que é E0 = 0,34 volt, e sabendo-se que o eletrodo de Fe(s) se dissolve, pergunta-se:
Qual é o potencial-padrão de redução de Fe2+ + 2 e – ----> Fe(s)?
1,12 V.
– 0,44 V.
– 1,12 V.
2,29 V.
0,44 V.
Considere a seguinte situação: um aluno misturou 50 mL de ácido forte a 150 mL de água destilada e colocou um pedaço de “palha de aço” dentro do recipiente para reagir. Em um segundo recipiente colocou apenas 50 mL de ácido forte e colocou também um pedaço de “palha de aço” para reagir conforme a figura abaixo representa.
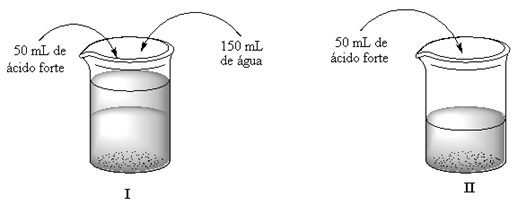
Com relação aos conceitos sobre os fatores que influenciam nas velocidades das reações, marque a alternativa que melhor explica qual é a mistura que reagiu com maior velocidade com a “palha de aço”.
As duas ocorrerão na mesma velocidade, já que não depende do fator concentração.
As duas ocorrerão na mesma velocidade, já que depende do fator concentração.
A situação I, por que quanto maior o volume da solução maior será a velocidade da reação.
A situação I, por que quanto maior o volume de água na solução maior será a velocidade da reação.
A situação II, por que quanto maior a concentração da solução ácida maior será a velocidade da reação.
Considere a reação hipotética: A + B ↔ C + D, com relação ao equilíbrio químico do sistema, em temperatura constante, pode-se afirmar que:
a adição de reagentes ao sistema desloca o equilíbrio no sentido de formação de reagentes, diminuindo o valor da constante de equilíbrio.
a adição de reagentes ao sistema desloca o equilíbrio no sentido de formação de produtos, aumentando o valor da constante de equilíbrio.
a adição de produtos ao sistema desloca o equilíbrio no sentido de formação de reagentes, diminuindo o valor da constante de equilíbrio.
a adição de produtos ao sistema desloca o equilíbrio do sistema no sentido de formação de produtos, aumentando o valor da constante de equilíbrio
a adição de reagentes ou de produtos ao sistema não afeta o valor da constante de equilíbrio.
0,015 mol/L.mim
0,06 mol/L.mim
0,03 mol/L.mim
0,06 mol/L.s
0,03 mol/L.s
Ao realizar a reação de formação da água a partir dos gases hidrogênio (H2) e oxigênio (O2), verificou-se que a velocidade de consumo de oxigênio foi de 4 mol/min. Determine a velocidade de consumo de hidrogênio.
2H2 + O2 à2H2O
1 mol/mim
10 mol/mim
8 mol/mim
4 mol/mim
2 mol/mim
Analisando a reação reversível abaixo, quando se estabelece o equilíbrio químico é possível afirmar que:
Vel. direta < Vel. inversa.
[N2] = [H2].
[NH3] = constante.
Vel. direta > Vel. inversa.
[N2] = [NH3].
Antes da utilização de câmeras digitais ser tão comum, a revelação de uma imagem fotográfica em um filme dependia da cinética química da redução do halogeneto de prata por um revelador. A tabela abaixo mostra o tempo de revelação de determinado filme usando um revelador D-76.

A velocidade média de revelação no intervalo de tempo de 7 min a 10 min é, em mol/min:
2,62
1,33
0,70
3,14
1,80
Um dos processos bastante comuns na industria de semi-jóias, é o banho de ouro. Em um desses processos, uma solução aquosa de cloreto de ouro (AuCl3) foi submetida à eletrólise durante 30min. Sabendo que a constante de Faraday igual a 96.500 C e a fórmula Q = i . t, assinale a alternativa que apresenta a corrente (i) em amperes, aplicada na célula para se obter 197 mg de ouro.
i = 0,100 A.
i = 2,06 A.
i = 0,38 A.
i = 0,16 A.
i = 0,05 A.
A produção do alumínio ocorre à partir da alumina (Al2O3) fundida, durante um processo de eletrólise. Nela, o íon Al+3 é reduzido, no cátodo, a Al. Imagine uma célula eletrolítica funcionando por 30h, na qual circulou uma corrente de 50 A (constante de Faraday = 96500 C). Assinale a alternativa que contém a massa correta de Al depositada.
1512 g
140 g
380 g
19 g
504 g
Durante um processo químico, ocorre eletrólise de uma solução de sulfato cúprico, com a seguinte redução catódica:
Cu2+(aq) + 2e- → Cu(s)
Quantos mols de íons de Cu2+(aq) são reduzidos por uma quantidade de eletricidade igual a 1,0 faraday?
2,5
1,0
2,0
1,5
0,50
Em um laboratório, um técnico monta uma pilha-padrão formada por Cu/Cu(NO3)2 e Fe/FeSO4 apresenta um potencial (ddp) igual a 0,78 volt. Conhecendo-se o potencial-padrão de redução de Cu2+ + 2 e – ----> Cu , que é E0 = 0,34 volt, e sabendo-se que o eletrodo de Fe(s) se dissolve, pergunta-se:
Qual é o potencial-padrão de redução de Fe2+ + 2 e – ----> Fe(s)?
1,12 V.
– 0,44 V.
– 1,12 V.
2,29 V.
0,44 V.
Considere a seguinte situação: um aluno misturou 50 mL de ácido forte a 150 mL de água destilada e colocou um pedaço de “palha de aço” dentro do recipiente para reagir. Em um segundo recipiente colocou apenas 50 mL de ácido forte e colocou também um pedaço de “palha de aço” para reagir conforme a figura abaixo representa.

Com relação aos conceitos sobre os fatores que influenciam nas velocidades das reações, marque a alternativa que melhor explica qual é a mistura que reagiu com maior velocidade com a “palha de aço”.
As duas ocorrerão na mesma velocidade, já que não depende do fator concentração.
As duas ocorrerão na mesma velocidade, já que depende do fator concentração.
A situação I, por que quanto maior o volume da solução maior será a velocidade da reação.
A situação I, por que quanto maior o volume de água na solução maior será a velocidade da reação.
A situação II, por que quanto maior a concentração da solução ácida maior será a velocidade da reação.
Considere a reação hipotética: A + B ↔ C + D, com relação ao equilíbrio químico do sistema, em temperatura constante, pode-se afirmar que:
a adição de reagentes ao sistema desloca o equilíbrio no sentido de formação de reagentes, diminuindo o valor da constante de equilíbrio.
a adição de reagentes ao sistema desloca o equilíbrio no sentido de formação de produtos, aumentando o valor da constante de equilíbrio.
a adição de produtos ao sistema desloca o equilíbrio no sentido de formação de reagentes, diminuindo o valor da constante de equilíbrio.
a adição de produtos ao sistema desloca o equilíbrio do sistema no sentido de formação de produtos, aumentando o valor da constante de equilíbrio
a adição de reagentes ou de produtos ao sistema não afeta o valor da constante de equilíbrio.
1 mol/mim
10 mol/mim
8 mol/mim
4 mol/mim
2 mol/mim
Analisando a reação reversível abaixo, quando se estabelece o equilíbrio químico é possível afirmar que:
Vel. direta < Vel. inversa.
[N2] = [H2].
[NH3] = constante.
Vel. direta > Vel. inversa.
[N2] = [NH3].
Antes da utilização de câmeras digitais ser tão comum, a revelação de uma imagem fotográfica em um filme dependia da cinética química da redução do halogeneto de prata por um revelador. A tabela abaixo mostra o tempo de revelação de determinado filme usando um revelador D-76.

A velocidade média de revelação no intervalo de tempo de 7 min a 10 min é, em mol/min:
2,62
1,33
0,70
3,14
1,80
Um dos processos bastante comuns na industria de semi-jóias, é o banho de ouro. Em um desses processos, uma solução aquosa de cloreto de ouro (AuCl3) foi submetida à eletrólise durante 30min. Sabendo que a constante de Faraday igual a 96.500 C e a fórmula Q = i . t, assinale a alternativa que apresenta a corrente (i) em amperes, aplicada na célula para se obter 197 mg de ouro.
i = 0,100 A.
i = 2,06 A.
i = 0,38 A.
i = 0,16 A.
i = 0,05 A.
A produção do alumínio ocorre à partir da alumina (Al2O3) fundida, durante um processo de eletrólise. Nela, o íon Al+3 é reduzido, no cátodo, a Al. Imagine uma célula eletrolítica funcionando por 30h, na qual circulou uma corrente de 50 A (constante de Faraday = 96500 C). Assinale a alternativa que contém a massa correta de Al depositada.
1512 g
140 g
380 g
19 g
504 g
Durante um processo químico, ocorre eletrólise de uma solução de sulfato cúprico, com a seguinte redução catódica:
Cu2+(aq) + 2e- → Cu(s)
Quantos mols de íons de Cu2+(aq) são reduzidos por uma quantidade de eletricidade igual a 1,0 faraday?
2,5
1,0
2,0
1,5
0,50
Em um laboratório, um técnico monta uma pilha-padrão formada por Cu/Cu(NO3)2 e Fe/FeSO4 apresenta um potencial (ddp) igual a 0,78 volt. Conhecendo-se o potencial-padrão de redução de Cu2+ + 2 e – ----> Cu , que é E0 = 0,34 volt, e sabendo-se que o eletrodo de Fe(s) se dissolve, pergunta-se:
Qual é o potencial-padrão de redução de Fe2+ + 2 e – ----> Fe(s)?
1,12 V.
– 0,44 V.
– 1,12 V.
2,29 V.
0,44 V.
Considere a seguinte situação: um aluno misturou 50 mL de ácido forte a 150 mL de água destilada e colocou um pedaço de “palha de aço” dentro do recipiente para reagir. Em um segundo recipiente colocou apenas 50 mL de ácido forte e colocou também um pedaço de “palha de aço” para reagir conforme a figura abaixo representa.

Com relação aos conceitos sobre os fatores que influenciam nas velocidades das reações, marque a alternativa que melhor explica qual é a mistura que reagiu com maior velocidade com a “palha de aço”.
As duas ocorrerão na mesma velocidade, já que não depende do fator concentração.
As duas ocorrerão na mesma velocidade, já que depende do fator concentração.
A situação I, por que quanto maior o volume da solução maior será a velocidade da reação.
A situação I, por que quanto maior o volume de água na solução maior será a velocidade da reação.
A situação II, por que quanto maior a concentração da solução ácida maior será a velocidade da reação.
Considere a reação hipotética: A + B ↔ C + D, com relação ao equilíbrio químico do sistema, em temperatura constante, pode-se afirmar que:
a adição de reagentes ao sistema desloca o equilíbrio no sentido de formação de reagentes, diminuindo o valor da constante de equilíbrio.
a adição de reagentes ao sistema desloca o equilíbrio no sentido de formação de produtos, aumentando o valor da constante de equilíbrio.
a adição de produtos ao sistema desloca o equilíbrio no sentido de formação de reagentes, diminuindo o valor da constante de equilíbrio.
a adição de produtos ao sistema desloca o equilíbrio do sistema no sentido de formação de produtos, aumentando o valor da constante de equilíbrio
a adição de reagentes ou de produtos ao sistema não afeta o valor da constante de equilíbrio.

Vel. direta < Vel. inversa.
[N2] = [H2].
[NH3] = constante.
Vel. direta > Vel. inversa.
[N2] = [NH3].
Antes da utilização de câmeras digitais ser tão comum, a revelação de uma imagem fotográfica em um filme dependia da cinética química da redução do halogeneto de prata por um revelador. A tabela abaixo mostra o tempo de revelação de determinado filme usando um revelador D-76.

A velocidade média de revelação no intervalo de tempo de 7 min a 10 min é, em mol/min:
2,62
1,33
0,70
3,14
1,80
Um dos processos bastante comuns na industria de semi-jóias, é o banho de ouro. Em um desses processos, uma solução aquosa de cloreto de ouro (AuCl3) foi submetida à eletrólise durante 30min. Sabendo que a constante de Faraday igual a 96.500 C e a fórmula Q = i . t, assinale a alternativa que apresenta a corrente (i) em amperes, aplicada na célula para se obter 197 mg de ouro.
i = 0,100 A.
i = 2,06 A.
i = 0,38 A.
i = 0,16 A.
i = 0,05 A.
A produção do alumínio ocorre à partir da alumina (Al2O3) fundida, durante um processo de eletrólise. Nela, o íon Al+3 é reduzido, no cátodo, a Al. Imagine uma célula eletrolítica funcionando por 30h, na qual circulou uma corrente de 50 A (constante de Faraday = 96500 C). Assinale a alternativa que contém a massa correta de Al depositada.
1512 g
140 g
380 g
19 g
504 g
Durante um processo químico, ocorre eletrólise de uma solução de sulfato cúprico, com a seguinte redução catódica:
Cu2+(aq) + 2e- → Cu(s)
Quantos mols de íons de Cu2+(aq) são reduzidos por uma quantidade de eletricidade igual a 1,0 faraday?
2,5
1,0
2,0
1,5
0,50
Em um laboratório, um técnico monta uma pilha-padrão formada por Cu/Cu(NO3)2 e Fe/FeSO4 apresenta um potencial (ddp) igual a 0,78 volt. Conhecendo-se o potencial-padrão de redução de Cu2+ + 2 e – ----> Cu , que é E0 = 0,34 volt, e sabendo-se que o eletrodo de Fe(s) se dissolve, pergunta-se:
Qual é o potencial-padrão de redução de Fe2+ + 2 e – ----> Fe(s)?
1,12 V.
– 0,44 V.
– 1,12 V.
2,29 V.
0,44 V.
Considere a seguinte situação: um aluno misturou 50 mL de ácido forte a 150 mL de água destilada e colocou um pedaço de “palha de aço” dentro do recipiente para reagir. Em um segundo recipiente colocou apenas 50 mL de ácido forte e colocou também um pedaço de “palha de aço” para reagir conforme a figura abaixo representa.

Com relação aos conceitos sobre os fatores que influenciam nas velocidades das reações, marque a alternativa que melhor explica qual é a mistura que reagiu com maior velocidade com a “palha de aço”.
As duas ocorrerão na mesma velocidade, já que não depende do fator concentração.
As duas ocorrerão na mesma velocidade, já que depende do fator concentração.
A situação I, por que quanto maior o volume da solução maior será a velocidade da reação.
A situação I, por que quanto maior o volume de água na solução maior será a velocidade da reação.
A situação II, por que quanto maior a concentração da solução ácida maior será a velocidade da reação.
Considere a reação hipotética: A + B ↔ C + D, com relação ao equilíbrio químico do sistema, em temperatura constante, pode-se afirmar que:
a adição de reagentes ao sistema desloca o equilíbrio no sentido de formação de reagentes, diminuindo o valor da constante de equilíbrio.
a adição de reagentes ao sistema desloca o equilíbrio no sentido de formação de produtos, aumentando o valor da constante de equilíbrio.
a adição de produtos ao sistema desloca o equilíbrio no sentido de formação de reagentes, diminuindo o valor da constante de equilíbrio.
a adição de produtos ao sistema desloca o equilíbrio do sistema no sentido de formação de produtos, aumentando o valor da constante de equilíbrio
a adição de reagentes ou de produtos ao sistema não afeta o valor da constante de equilíbrio.

2,62
1,33
0,70
3,14
1,80
Um dos processos bastante comuns na industria de semi-jóias, é o banho de ouro. Em um desses processos, uma solução aquosa de cloreto de ouro (AuCl3) foi submetida à eletrólise durante 30min. Sabendo que a constante de Faraday igual a 96.500 C e a fórmula Q = i . t, assinale a alternativa que apresenta a corrente (i) em amperes, aplicada na célula para se obter 197 mg de ouro.
i = 0,100 A.
i = 2,06 A.
i = 0,38 A.
i = 0,16 A.
i = 0,05 A.
A produção do alumínio ocorre à partir da alumina (Al2O3) fundida, durante um processo de eletrólise. Nela, o íon Al+3 é reduzido, no cátodo, a Al. Imagine uma célula eletrolítica funcionando por 30h, na qual circulou uma corrente de 50 A (constante de Faraday = 96500 C). Assinale a alternativa que contém a massa correta de Al depositada.
1512 g
140 g
380 g
19 g
504 g
Durante um processo químico, ocorre eletrólise de uma solução de sulfato cúprico, com a seguinte redução catódica:
Cu2+(aq) + 2e- → Cu(s)
Quantos mols de íons de Cu2+(aq) são reduzidos por uma quantidade de eletricidade igual a 1,0 faraday?
2,5
1,0
2,0
1,5
0,50
Em um laboratório, um técnico monta uma pilha-padrão formada por Cu/Cu(NO3)2 e Fe/FeSO4 apresenta um potencial (ddp) igual a 0,78 volt. Conhecendo-se o potencial-padrão de redução de Cu2+ + 2 e – ----> Cu , que é E0 = 0,34 volt, e sabendo-se que o eletrodo de Fe(s) se dissolve, pergunta-se:
Qual é o potencial-padrão de redução de Fe2+ + 2 e – ----> Fe(s)?
1,12 V.
– 0,44 V.
– 1,12 V.
2,29 V.
0,44 V.
Considere a seguinte situação: um aluno misturou 50 mL de ácido forte a 150 mL de água destilada e colocou um pedaço de “palha de aço” dentro do recipiente para reagir. Em um segundo recipiente colocou apenas 50 mL de ácido forte e colocou também um pedaço de “palha de aço” para reagir conforme a figura abaixo representa.

Com relação aos conceitos sobre os fatores que influenciam nas velocidades das reações, marque a alternativa que melhor explica qual é a mistura que reagiu com maior velocidade com a “palha de aço”.
As duas ocorrerão na mesma velocidade, já que não depende do fator concentração.
As duas ocorrerão na mesma velocidade, já que depende do fator concentração.
A situação I, por que quanto maior o volume da solução maior será a velocidade da reação.
A situação I, por que quanto maior o volume de água na solução maior será a velocidade da reação.
A situação II, por que quanto maior a concentração da solução ácida maior será a velocidade da reação.
Considere a reação hipotética: A + B ↔ C + D, com relação ao equilíbrio químico do sistema, em temperatura constante, pode-se afirmar que:
a adição de reagentes ao sistema desloca o equilíbrio no sentido de formação de reagentes, diminuindo o valor da constante de equilíbrio.
a adição de reagentes ao sistema desloca o equilíbrio no sentido de formação de produtos, aumentando o valor da constante de equilíbrio.
a adição de produtos ao sistema desloca o equilíbrio no sentido de formação de reagentes, diminuindo o valor da constante de equilíbrio.
a adição de produtos ao sistema desloca o equilíbrio do sistema no sentido de formação de produtos, aumentando o valor da constante de equilíbrio
a adição de reagentes ou de produtos ao sistema não afeta o valor da constante de equilíbrio.
i = 0,100 A.
i = 2,06 A.
i = 0,38 A.
i = 0,16 A.
i = 0,05 A.
A produção do alumínio ocorre à partir da alumina (Al2O3) fundida, durante um processo de eletrólise. Nela, o íon Al+3 é reduzido, no cátodo, a Al. Imagine uma célula eletrolítica funcionando por 30h, na qual circulou uma corrente de 50 A (constante de Faraday = 96500 C). Assinale a alternativa que contém a massa correta de Al depositada.
1512 g
140 g
380 g
19 g
504 g
Durante um processo químico, ocorre eletrólise de uma solução de sulfato cúprico, com a seguinte redução catódica:
Cu2+(aq) + 2e- → Cu(s)
Quantos mols de íons de Cu2+(aq) são reduzidos por uma quantidade de eletricidade igual a 1,0 faraday?
2,5
1,0
2,0
1,5
0,50
Em um laboratório, um técnico monta uma pilha-padrão formada por Cu/Cu(NO3)2 e Fe/FeSO4 apresenta um potencial (ddp) igual a 0,78 volt. Conhecendo-se o potencial-padrão de redução de Cu2+ + 2 e – ----> Cu , que é E0 = 0,34 volt, e sabendo-se que o eletrodo de Fe(s) se dissolve, pergunta-se:
Qual é o potencial-padrão de redução de Fe2+ + 2 e – ----> Fe(s)?
1,12 V.
– 0,44 V.
– 1,12 V.
2,29 V.
0,44 V.
Considere a seguinte situação: um aluno misturou 50 mL de ácido forte a 150 mL de água destilada e colocou um pedaço de “palha de aço” dentro do recipiente para reagir. Em um segundo recipiente colocou apenas 50 mL de ácido forte e colocou também um pedaço de “palha de aço” para reagir conforme a figura abaixo representa.

Com relação aos conceitos sobre os fatores que influenciam nas velocidades das reações, marque a alternativa que melhor explica qual é a mistura que reagiu com maior velocidade com a “palha de aço”.
As duas ocorrerão na mesma velocidade, já que não depende do fator concentração.
As duas ocorrerão na mesma velocidade, já que depende do fator concentração.
A situação I, por que quanto maior o volume da solução maior será a velocidade da reação.
A situação I, por que quanto maior o volume de água na solução maior será a velocidade da reação.
A situação II, por que quanto maior a concentração da solução ácida maior será a velocidade da reação.
Considere a reação hipotética: A + B ↔ C + D, com relação ao equilíbrio químico do sistema, em temperatura constante, pode-se afirmar que:
a adição de reagentes ao sistema desloca o equilíbrio no sentido de formação de reagentes, diminuindo o valor da constante de equilíbrio.
a adição de reagentes ao sistema desloca o equilíbrio no sentido de formação de produtos, aumentando o valor da constante de equilíbrio.
a adição de produtos ao sistema desloca o equilíbrio no sentido de formação de reagentes, diminuindo o valor da constante de equilíbrio.
a adição de produtos ao sistema desloca o equilíbrio do sistema no sentido de formação de produtos, aumentando o valor da constante de equilíbrio
a adição de reagentes ou de produtos ao sistema não afeta o valor da constante de equilíbrio.
1512 g
140 g
380 g
19 g
504 g
Durante um processo químico, ocorre eletrólise de uma solução de sulfato cúprico, com a seguinte redução catódica:
Cu2+(aq) + 2e- → Cu(s)
Quantos mols de íons de Cu2+(aq) são reduzidos por uma quantidade de eletricidade igual a 1,0 faraday?
2,5
1,0
2,0
1,5
0,50
Em um laboratório, um técnico monta uma pilha-padrão formada por Cu/Cu(NO3)2 e Fe/FeSO4 apresenta um potencial (ddp) igual a 0,78 volt. Conhecendo-se o potencial-padrão de redução de Cu2+ + 2 e – ----> Cu , que é E0 = 0,34 volt, e sabendo-se que o eletrodo de Fe(s) se dissolve, pergunta-se:
Qual é o potencial-padrão de redução de Fe2+ + 2 e – ----> Fe(s)?
1,12 V.
– 0,44 V.
– 1,12 V.
2,29 V.
0,44 V.
Considere a seguinte situação: um aluno misturou 50 mL de ácido forte a 150 mL de água destilada e colocou um pedaço de “palha de aço” dentro do recipiente para reagir. Em um segundo recipiente colocou apenas 50 mL de ácido forte e colocou também um pedaço de “palha de aço” para reagir conforme a figura abaixo representa.

Com relação aos conceitos sobre os fatores que influenciam nas velocidades das reações, marque a alternativa que melhor explica qual é a mistura que reagiu com maior velocidade com a “palha de aço”.
As duas ocorrerão na mesma velocidade, já que não depende do fator concentração.
As duas ocorrerão na mesma velocidade, já que depende do fator concentração.
A situação I, por que quanto maior o volume da solução maior será a velocidade da reação.
A situação I, por que quanto maior o volume de água na solução maior será a velocidade da reação.
A situação II, por que quanto maior a concentração da solução ácida maior será a velocidade da reação.
Considere a reação hipotética: A + B ↔ C + D, com relação ao equilíbrio químico do sistema, em temperatura constante, pode-se afirmar que:
a adição de reagentes ao sistema desloca o equilíbrio no sentido de formação de reagentes, diminuindo o valor da constante de equilíbrio.
a adição de reagentes ao sistema desloca o equilíbrio no sentido de formação de produtos, aumentando o valor da constante de equilíbrio.
a adição de produtos ao sistema desloca o equilíbrio no sentido de formação de reagentes, diminuindo o valor da constante de equilíbrio.
a adição de produtos ao sistema desloca o equilíbrio do sistema no sentido de formação de produtos, aumentando o valor da constante de equilíbrio
a adição de reagentes ou de produtos ao sistema não afeta o valor da constante de equilíbrio.
2,5
1,0
2,0
1,5
0,50
Em um laboratório, um técnico monta uma pilha-padrão formada por Cu/Cu(NO3)2 e Fe/FeSO4 apresenta um potencial (ddp) igual a 0,78 volt. Conhecendo-se o potencial-padrão de redução de Cu2+ + 2 e – ----> Cu , que é E0 = 0,34 volt, e sabendo-se que o eletrodo de Fe(s) se dissolve, pergunta-se:
Qual é o potencial-padrão de redução de Fe2+ + 2 e – ----> Fe(s)?
1,12 V.
– 0,44 V.
– 1,12 V.
2,29 V.
0,44 V.
Considere a seguinte situação: um aluno misturou 50 mL de ácido forte a 150 mL de água destilada e colocou um pedaço de “palha de aço” dentro do recipiente para reagir. Em um segundo recipiente colocou apenas 50 mL de ácido forte e colocou também um pedaço de “palha de aço” para reagir conforme a figura abaixo representa.

Com relação aos conceitos sobre os fatores que influenciam nas velocidades das reações, marque a alternativa que melhor explica qual é a mistura que reagiu com maior velocidade com a “palha de aço”.
As duas ocorrerão na mesma velocidade, já que não depende do fator concentração.
As duas ocorrerão na mesma velocidade, já que depende do fator concentração.
A situação I, por que quanto maior o volume da solução maior será a velocidade da reação.
A situação I, por que quanto maior o volume de água na solução maior será a velocidade da reação.
A situação II, por que quanto maior a concentração da solução ácida maior será a velocidade da reação.
Considere a reação hipotética: A + B ↔ C + D, com relação ao equilíbrio químico do sistema, em temperatura constante, pode-se afirmar que:
a adição de reagentes ao sistema desloca o equilíbrio no sentido de formação de reagentes, diminuindo o valor da constante de equilíbrio.
a adição de reagentes ao sistema desloca o equilíbrio no sentido de formação de produtos, aumentando o valor da constante de equilíbrio.
a adição de produtos ao sistema desloca o equilíbrio no sentido de formação de reagentes, diminuindo o valor da constante de equilíbrio.
a adição de produtos ao sistema desloca o equilíbrio do sistema no sentido de formação de produtos, aumentando o valor da constante de equilíbrio
a adição de reagentes ou de produtos ao sistema não afeta o valor da constante de equilíbrio.
Qual é o potencial-padrão de redução de Fe2+ + 2 e – ----> Fe(s)?
1,12 V.
– 0,44 V.
– 1,12 V.
2,29 V.
0,44 V.
Considere a seguinte situação: um aluno misturou 50 mL de ácido forte a 150 mL de água destilada e colocou um pedaço de “palha de aço” dentro do recipiente para reagir. Em um segundo recipiente colocou apenas 50 mL de ácido forte e colocou também um pedaço de “palha de aço” para reagir conforme a figura abaixo representa.

Com relação aos conceitos sobre os fatores que influenciam nas velocidades das reações, marque a alternativa que melhor explica qual é a mistura que reagiu com maior velocidade com a “palha de aço”.
As duas ocorrerão na mesma velocidade, já que não depende do fator concentração.
As duas ocorrerão na mesma velocidade, já que depende do fator concentração.
A situação I, por que quanto maior o volume da solução maior será a velocidade da reação.
A situação I, por que quanto maior o volume de água na solução maior será a velocidade da reação.
A situação II, por que quanto maior a concentração da solução ácida maior será a velocidade da reação.
Considere a reação hipotética: A + B ↔ C + D, com relação ao equilíbrio químico do sistema, em temperatura constante, pode-se afirmar que:
a adição de reagentes ao sistema desloca o equilíbrio no sentido de formação de reagentes, diminuindo o valor da constante de equilíbrio.
a adição de reagentes ao sistema desloca o equilíbrio no sentido de formação de produtos, aumentando o valor da constante de equilíbrio.
a adição de produtos ao sistema desloca o equilíbrio no sentido de formação de reagentes, diminuindo o valor da constante de equilíbrio.
a adição de produtos ao sistema desloca o equilíbrio do sistema no sentido de formação de produtos, aumentando o valor da constante de equilíbrio
a adição de reagentes ou de produtos ao sistema não afeta o valor da constante de equilíbrio.

As duas ocorrerão na mesma velocidade, já que não depende do fator concentração.
As duas ocorrerão na mesma velocidade, já que depende do fator concentração.
A situação I, por que quanto maior o volume da solução maior será a velocidade da reação.
A situação I, por que quanto maior o volume de água na solução maior será a velocidade da reação.
A situação II, por que quanto maior a concentração da solução ácida maior será a velocidade da reação.
Considere a reação hipotética: A + B ↔ C + D, com relação ao equilíbrio químico do sistema, em temperatura constante, pode-se afirmar que:
a adição de reagentes ao sistema desloca o equilíbrio no sentido de formação de reagentes, diminuindo o valor da constante de equilíbrio.
a adição de reagentes ao sistema desloca o equilíbrio no sentido de formação de produtos, aumentando o valor da constante de equilíbrio.
a adição de produtos ao sistema desloca o equilíbrio no sentido de formação de reagentes, diminuindo o valor da constante de equilíbrio.
a adição de produtos ao sistema desloca o equilíbrio do sistema no sentido de formação de produtos, aumentando o valor da constante de equilíbrio
a adição de reagentes ou de produtos ao sistema não afeta o valor da constante de equilíbrio.
a adição de reagentes ao sistema desloca o equilíbrio no sentido de formação de reagentes, diminuindo o valor da constante de equilíbrio.
a adição de reagentes ao sistema desloca o equilíbrio no sentido de formação de produtos, aumentando o valor da constante de equilíbrio.
a adição de produtos ao sistema desloca o equilíbrio no sentido de formação de reagentes, diminuindo o valor da constante de equilíbrio.
a adição de produtos ao sistema desloca o equilíbrio do sistema no sentido de formação de produtos, aumentando o valor da constante de equilíbrio
a adição de reagentes ou de produtos ao sistema não afeta o valor da constante de equilíbrio.