FÍSICO-QUÍMICA II
O gás hidrogênio pode ser obtido industrialmente reagindo ferro metálico e vapor de água de acordo com a reação representada a seguir:
3 Fe(s) + 4H2O(g) → Fe3O4(s) + 4H2(g)
A 300°C, coloca-se 0,25 mol de Fe e 0,5 mol de vapor d'água. Ao se atingir o equilíbrio, observa-se a presença de 0,2 mol de vapor d'água. Assinale, a seguir, a alternativa que apresenta a constante de equilíbrio Kc, para a temperatura dada:
0,50
10,12
0,60
5,06
24,3
A forma Kc depende de qual reação (direta ou inversa) estamos nos referindo. Sendo assim, sabendo-se o valor de Kc para uma reação direta é possível calcular o Kc para a reação inversa, pois a expressão de equilíbrio da reação inversa é a recíproca do Kc da reação direta. Se sabemos de o Kc para a reação direta de 2HBr(g) <--> H2(g) + Br2(g) é 1,5 x 10-5. Qual será o valor de Kc para a reação inversa?
6,67 x 104.
6,67 x 10-4.
6,67.
1,5 x 10-5.
1,5 x 105.
O gráfico a seguir refere-se ao diagrama energético de uma reação química de decomposição da água oxigenada, onde se veem destacados dois caminhos (1 e 2) desta reação. Após uma analise das entalpias (energias) dos reagentes e produtos e seus valores fictícios (a, b e c), como mostrado no gráfico abaixo, pode-se tirar algumas conclusões sobre as velocidades das mesmas.
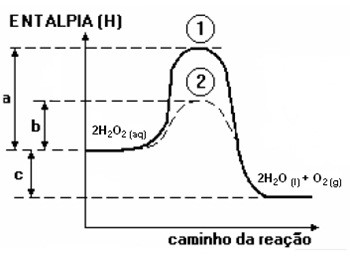
Baseado nestas informações e no gráfico, analise os itens a seguir:
I – a curva 2 é a referente ao uso do catalisador.
II – o catalisador é utilizado para aumentar a velocidade da reação, pois causa um aumento na energia de ativação.
III – a reação é exotérmica, pois a entalpia final (produtos) é menor que a entalpia inicial (reagentes).
Considerando as informações apresentadas e os conceitos sobre cinética química, podemos concluir que as afirmações corretas são:
somente III.
somente II.
Todas estão corretas
somente I.
somente I e III.
Quando determinamos a velocidade média de uma reação química, medimos a variação da concentração dos reagentes e/ou dos produtos formados em função do tempo. Para a produção da amônia, reagiu-se gás hidrogênio e gás nitrogênio e depois de 1 hora a concentração de hidrogênio diminuiu de 4,5 mmol/L para 2,75 mmol/L.
3H2 + N2à 2NH3
Calcule a velocidade média de consumo de hidrogênio.
1,17 mmol/L.h
2,75 mmol/L.h
1,75 mmol/L.h
4,5 mmol/L.h
3,5 mmol/L.h
Para diminuir a poluição atmosférica muitos carros utilizam conversores catalíticos que são dispositivos como "colméias" contendo catalisadores apropriados e por onde fluem os gases produzidos na combustão. Ocorrem reações complexas com transformações de substâncias tóxicas em não-tóxicas.
Das seguintes afirmações acerca dessas reações
I. são todas de catálise heterogênea.
II. os catalisadores são consumidos nas reações.
III. os catalisadores aumentam a superfície de contato entre os reagentes.
IV. baixas temperaturas provavelmente aumentam a eficácia dos conversores catalíticos.
Pode-se afirmar que SOMENTE
I e III estão corretas
II está correta
III está correta
II e IV estão corretas
I está correta
Pesquisas demonstraram a eficiência do óxido nítrico, NO, no tratamento de determinado tipo de doença pulmonar. Sendo facilmente oxidado a NO2, quando preparado em laboratório, o ácido nítrico deve ser recolhido em meio que não contenha oxigênio. Os Nox do nitrogênio no NO e NO2 são, respectivamente:
+ 3 e + 6.
+ 2 e + 2.
+ 2 e + 4.
zero e + 4.
zero e + 2.
De acordo com a equação abaixo é realizada segundo dois procedimentos:
NaHSO4+CH3COONa → CH3COOH + Na2SO4.
I. Triturando reagentes sólidos.
II. Misturando soluções aquosas concentradas dos reagentes.
Qual a alternativa que melhor atende quando se utiliza a mesma quantidade de NaHSO4 e mesma quantidade de CH3COONa nesses procedimentos, à mesma temperatura, a formação do ácido acético:
mais rápida em I porque o ácido acético é liberado na forma de vapor.
mais rápida em II porque em solução a frequência de colisões entre os reagentes é maior.
mais rápida em I porque no estado sólido a concentração dos reagentes é maior.
mais rápida em II porque o ácido acético se dissolve na água.
ocorre em I e II com igual velocidade porque os reagentes são os mesmos.
O tetróxido de dinitrogênio (N2O4) é uma substância usada em larga escala na produção de ácido nítrico. Quando abaixo de 21 ºC apresenta-se no estado líquido sendo decomposto em NO2 de acordo com a reação NÃO-BALANCEADA abaixo:
N2O4(g) --> NO2(g)
Em um balão volumétrico de 1000 mL são introduzidos 5,0 mols de tetróxido de dinitrogênio. Uma vez atingido o equilíbrio, restaram no sistema 1,3 mols deste reagente. Baseado nas informações dadas e na reação de decomposição do N2O4, calcule o valor da constante de equilíbrio (Kc).
32
10
25
42
38
Uma pilha-padrão que é formada por Cu/Cu(NO3)2 e Fe/FeSO4 ,apresenta um potencial igual a 0,78 volt. Conhecendo-se o potencial-padrão de redução de Cu2+ + 2 e – ---> Cu, que é E0 = 0,34 volt, e sabendo-se que o eletrodo de Fe(s) se dissolve, pergunta-se:
Qual é o potencial-padrão de redução de Fe2+ + 2 e – ----> Fe(s)?
0,50
10,12
0,60
5,06
24,3
A forma Kc depende de qual reação (direta ou inversa) estamos nos referindo. Sendo assim, sabendo-se o valor de Kc para uma reação direta é possível calcular o Kc para a reação inversa, pois a expressão de equilíbrio da reação inversa é a recíproca do Kc da reação direta. Se sabemos de o Kc para a reação direta de 2HBr(g) <--> H2(g) + Br2(g) é 1,5 x 10-5. Qual será o valor de Kc para a reação inversa?
6,67 x 104.
6,67 x 10-4.
6,67.
1,5 x 10-5.
1,5 x 105.
O gráfico a seguir refere-se ao diagrama energético de uma reação química de decomposição da água oxigenada, onde se veem destacados dois caminhos (1 e 2) desta reação. Após uma analise das entalpias (energias) dos reagentes e produtos e seus valores fictícios (a, b e c), como mostrado no gráfico abaixo, pode-se tirar algumas conclusões sobre as velocidades das mesmas.

Baseado nestas informações e no gráfico, analise os itens a seguir:
I – a curva 2 é a referente ao uso do catalisador.
II – o catalisador é utilizado para aumentar a velocidade da reação, pois causa um aumento na energia de ativação.
III – a reação é exotérmica, pois a entalpia final (produtos) é menor que a entalpia inicial (reagentes).
Considerando as informações apresentadas e os conceitos sobre cinética química, podemos concluir que as afirmações corretas são:
somente III.
somente II.
Todas estão corretas
somente I.
somente I e III.
Quando determinamos a velocidade média de uma reação química, medimos a variação da concentração dos reagentes e/ou dos produtos formados em função do tempo. Para a produção da amônia, reagiu-se gás hidrogênio e gás nitrogênio e depois de 1 hora a concentração de hidrogênio diminuiu de 4,5 mmol/L para 2,75 mmol/L.
3H2 + N2à 2NH3
Calcule a velocidade média de consumo de hidrogênio.
1,17 mmol/L.h
2,75 mmol/L.h
1,75 mmol/L.h
4,5 mmol/L.h
3,5 mmol/L.h
Para diminuir a poluição atmosférica muitos carros utilizam conversores catalíticos que são dispositivos como "colméias" contendo catalisadores apropriados e por onde fluem os gases produzidos na combustão. Ocorrem reações complexas com transformações de substâncias tóxicas em não-tóxicas.
Das seguintes afirmações acerca dessas reações
I. são todas de catálise heterogênea.
II. os catalisadores são consumidos nas reações.
III. os catalisadores aumentam a superfície de contato entre os reagentes.
IV. baixas temperaturas provavelmente aumentam a eficácia dos conversores catalíticos.
Pode-se afirmar que SOMENTE
I e III estão corretas
II está correta
III está correta
II e IV estão corretas
I está correta
Pesquisas demonstraram a eficiência do óxido nítrico, NO, no tratamento de determinado tipo de doença pulmonar. Sendo facilmente oxidado a NO2, quando preparado em laboratório, o ácido nítrico deve ser recolhido em meio que não contenha oxigênio. Os Nox do nitrogênio no NO e NO2 são, respectivamente:
+ 3 e + 6.
+ 2 e + 2.
+ 2 e + 4.
zero e + 4.
zero e + 2.
De acordo com a equação abaixo é realizada segundo dois procedimentos:
NaHSO4+CH3COONa → CH3COOH + Na2SO4.
I. Triturando reagentes sólidos.
II. Misturando soluções aquosas concentradas dos reagentes.
Qual a alternativa que melhor atende quando se utiliza a mesma quantidade de NaHSO4 e mesma quantidade de CH3COONa nesses procedimentos, à mesma temperatura, a formação do ácido acético:
mais rápida em I porque o ácido acético é liberado na forma de vapor.
mais rápida em II porque em solução a frequência de colisões entre os reagentes é maior.
mais rápida em I porque no estado sólido a concentração dos reagentes é maior.
mais rápida em II porque o ácido acético se dissolve na água.
ocorre em I e II com igual velocidade porque os reagentes são os mesmos.
O tetróxido de dinitrogênio (N2O4) é uma substância usada em larga escala na produção de ácido nítrico. Quando abaixo de 21 ºC apresenta-se no estado líquido sendo decomposto em NO2 de acordo com a reação NÃO-BALANCEADA abaixo:
N2O4(g) --> NO2(g)
Em um balão volumétrico de 1000 mL são introduzidos 5,0 mols de tetróxido de dinitrogênio. Uma vez atingido o equilíbrio, restaram no sistema 1,3 mols deste reagente. Baseado nas informações dadas e na reação de decomposição do N2O4, calcule o valor da constante de equilíbrio (Kc).
32
10
25
42
38
Uma pilha-padrão que é formada por Cu/Cu(NO3)2 e Fe/FeSO4 ,apresenta um potencial igual a 0,78 volt. Conhecendo-se o potencial-padrão de redução de Cu2+ + 2 e – ---> Cu, que é E0 = 0,34 volt, e sabendo-se que o eletrodo de Fe(s) se dissolve, pergunta-se:
Qual é o potencial-padrão de redução de Fe2+ + 2 e – ----> Fe(s)?
6,67 x 104.
6,67 x 10-4.
6,67.
1,5 x 10-5.
1,5 x 105.
O gráfico a seguir refere-se ao diagrama energético de uma reação química de decomposição da água oxigenada, onde se veem destacados dois caminhos (1 e 2) desta reação. Após uma analise das entalpias (energias) dos reagentes e produtos e seus valores fictícios (a, b e c), como mostrado no gráfico abaixo, pode-se tirar algumas conclusões sobre as velocidades das mesmas.

Baseado nestas informações e no gráfico, analise os itens a seguir:
I – a curva 2 é a referente ao uso do catalisador.
II – o catalisador é utilizado para aumentar a velocidade da reação, pois causa um aumento na energia de ativação.
III – a reação é exotérmica, pois a entalpia final (produtos) é menor que a entalpia inicial (reagentes).
Considerando as informações apresentadas e os conceitos sobre cinética química, podemos concluir que as afirmações corretas são:
somente III.
somente II.
Todas estão corretas
somente I.
somente I e III.
Quando determinamos a velocidade média de uma reação química, medimos a variação da concentração dos reagentes e/ou dos produtos formados em função do tempo. Para a produção da amônia, reagiu-se gás hidrogênio e gás nitrogênio e depois de 1 hora a concentração de hidrogênio diminuiu de 4,5 mmol/L para 2,75 mmol/L.
3H2 + N2à 2NH3
Calcule a velocidade média de consumo de hidrogênio.
1,17 mmol/L.h
2,75 mmol/L.h
1,75 mmol/L.h
4,5 mmol/L.h
3,5 mmol/L.h
Para diminuir a poluição atmosférica muitos carros utilizam conversores catalíticos que são dispositivos como "colméias" contendo catalisadores apropriados e por onde fluem os gases produzidos na combustão. Ocorrem reações complexas com transformações de substâncias tóxicas em não-tóxicas.
Das seguintes afirmações acerca dessas reações
I. são todas de catálise heterogênea.
II. os catalisadores são consumidos nas reações.
III. os catalisadores aumentam a superfície de contato entre os reagentes.
IV. baixas temperaturas provavelmente aumentam a eficácia dos conversores catalíticos.
Pode-se afirmar que SOMENTE
I e III estão corretas
II está correta
III está correta
II e IV estão corretas
I está correta
Pesquisas demonstraram a eficiência do óxido nítrico, NO, no tratamento de determinado tipo de doença pulmonar. Sendo facilmente oxidado a NO2, quando preparado em laboratório, o ácido nítrico deve ser recolhido em meio que não contenha oxigênio. Os Nox do nitrogênio no NO e NO2 são, respectivamente:
+ 3 e + 6.
+ 2 e + 2.
+ 2 e + 4.
zero e + 4.
zero e + 2.
De acordo com a equação abaixo é realizada segundo dois procedimentos:
NaHSO4+CH3COONa → CH3COOH + Na2SO4.
I. Triturando reagentes sólidos.
II. Misturando soluções aquosas concentradas dos reagentes.
Qual a alternativa que melhor atende quando se utiliza a mesma quantidade de NaHSO4 e mesma quantidade de CH3COONa nesses procedimentos, à mesma temperatura, a formação do ácido acético:
mais rápida em I porque o ácido acético é liberado na forma de vapor.
mais rápida em II porque em solução a frequência de colisões entre os reagentes é maior.
mais rápida em I porque no estado sólido a concentração dos reagentes é maior.
mais rápida em II porque o ácido acético se dissolve na água.
ocorre em I e II com igual velocidade porque os reagentes são os mesmos.
O tetróxido de dinitrogênio (N2O4) é uma substância usada em larga escala na produção de ácido nítrico. Quando abaixo de 21 ºC apresenta-se no estado líquido sendo decomposto em NO2 de acordo com a reação NÃO-BALANCEADA abaixo:
N2O4(g) --> NO2(g)
Em um balão volumétrico de 1000 mL são introduzidos 5,0 mols de tetróxido de dinitrogênio. Uma vez atingido o equilíbrio, restaram no sistema 1,3 mols deste reagente. Baseado nas informações dadas e na reação de decomposição do N2O4, calcule o valor da constante de equilíbrio (Kc).
32
10
25
42
38
Uma pilha-padrão que é formada por Cu/Cu(NO3)2 e Fe/FeSO4 ,apresenta um potencial igual a 0,78 volt. Conhecendo-se o potencial-padrão de redução de Cu2+ + 2 e – ---> Cu, que é E0 = 0,34 volt, e sabendo-se que o eletrodo de Fe(s) se dissolve, pergunta-se:
Qual é o potencial-padrão de redução de Fe2+ + 2 e – ----> Fe(s)?

somente III.
somente II.
Todas estão corretas
somente I.
somente I e III.
Quando determinamos a velocidade média de uma reação química, medimos a variação da concentração dos reagentes e/ou dos produtos formados em função do tempo. Para a produção da amônia, reagiu-se gás hidrogênio e gás nitrogênio e depois de 1 hora a concentração de hidrogênio diminuiu de 4,5 mmol/L para 2,75 mmol/L.
3H2 + N2à 2NH3
Calcule a velocidade média de consumo de hidrogênio.
1,17 mmol/L.h
2,75 mmol/L.h
1,75 mmol/L.h
4,5 mmol/L.h
3,5 mmol/L.h
Para diminuir a poluição atmosférica muitos carros utilizam conversores catalíticos que são dispositivos como "colméias" contendo catalisadores apropriados e por onde fluem os gases produzidos na combustão. Ocorrem reações complexas com transformações de substâncias tóxicas em não-tóxicas.
Das seguintes afirmações acerca dessas reações
I. são todas de catálise heterogênea.
II. os catalisadores são consumidos nas reações.
III. os catalisadores aumentam a superfície de contato entre os reagentes.
IV. baixas temperaturas provavelmente aumentam a eficácia dos conversores catalíticos.
Pode-se afirmar que SOMENTE
I e III estão corretas
II está correta
III está correta
II e IV estão corretas
I está correta
Pesquisas demonstraram a eficiência do óxido nítrico, NO, no tratamento de determinado tipo de doença pulmonar. Sendo facilmente oxidado a NO2, quando preparado em laboratório, o ácido nítrico deve ser recolhido em meio que não contenha oxigênio. Os Nox do nitrogênio no NO e NO2 são, respectivamente:
+ 3 e + 6.
+ 2 e + 2.
+ 2 e + 4.
zero e + 4.
zero e + 2.
De acordo com a equação abaixo é realizada segundo dois procedimentos:
NaHSO4+CH3COONa → CH3COOH + Na2SO4.
I. Triturando reagentes sólidos.
II. Misturando soluções aquosas concentradas dos reagentes.
Qual a alternativa que melhor atende quando se utiliza a mesma quantidade de NaHSO4 e mesma quantidade de CH3COONa nesses procedimentos, à mesma temperatura, a formação do ácido acético:
mais rápida em I porque o ácido acético é liberado na forma de vapor.
mais rápida em II porque em solução a frequência de colisões entre os reagentes é maior.
mais rápida em I porque no estado sólido a concentração dos reagentes é maior.
mais rápida em II porque o ácido acético se dissolve na água.
ocorre em I e II com igual velocidade porque os reagentes são os mesmos.
O tetróxido de dinitrogênio (N2O4) é uma substância usada em larga escala na produção de ácido nítrico. Quando abaixo de 21 ºC apresenta-se no estado líquido sendo decomposto em NO2 de acordo com a reação NÃO-BALANCEADA abaixo:
N2O4(g) --> NO2(g)
Em um balão volumétrico de 1000 mL são introduzidos 5,0 mols de tetróxido de dinitrogênio. Uma vez atingido o equilíbrio, restaram no sistema 1,3 mols deste reagente. Baseado nas informações dadas e na reação de decomposição do N2O4, calcule o valor da constante de equilíbrio (Kc).
32
10
25
42
38
Uma pilha-padrão que é formada por Cu/Cu(NO3)2 e Fe/FeSO4 ,apresenta um potencial igual a 0,78 volt. Conhecendo-se o potencial-padrão de redução de Cu2+ + 2 e – ---> Cu, que é E0 = 0,34 volt, e sabendo-se que o eletrodo de Fe(s) se dissolve, pergunta-se:
Qual é o potencial-padrão de redução de Fe2+ + 2 e – ----> Fe(s)?
1,17 mmol/L.h
2,75 mmol/L.h
1,75 mmol/L.h
4,5 mmol/L.h
3,5 mmol/L.h
Para diminuir a poluição atmosférica muitos carros utilizam conversores catalíticos que são dispositivos como "colméias" contendo catalisadores apropriados e por onde fluem os gases produzidos na combustão. Ocorrem reações complexas com transformações de substâncias tóxicas em não-tóxicas.
Das seguintes afirmações acerca dessas reações
I. são todas de catálise heterogênea.
II. os catalisadores são consumidos nas reações.
III. os catalisadores aumentam a superfície de contato entre os reagentes.
IV. baixas temperaturas provavelmente aumentam a eficácia dos conversores catalíticos.
Pode-se afirmar que SOMENTE
I e III estão corretas
II está correta
III está correta
II e IV estão corretas
I está correta
Pesquisas demonstraram a eficiência do óxido nítrico, NO, no tratamento de determinado tipo de doença pulmonar. Sendo facilmente oxidado a NO2, quando preparado em laboratório, o ácido nítrico deve ser recolhido em meio que não contenha oxigênio. Os Nox do nitrogênio no NO e NO2 são, respectivamente:
+ 3 e + 6.
+ 2 e + 2.
+ 2 e + 4.
zero e + 4.
zero e + 2.
De acordo com a equação abaixo é realizada segundo dois procedimentos:
NaHSO4+CH3COONa → CH3COOH + Na2SO4.
I. Triturando reagentes sólidos.
II. Misturando soluções aquosas concentradas dos reagentes.
Qual a alternativa que melhor atende quando se utiliza a mesma quantidade de NaHSO4 e mesma quantidade de CH3COONa nesses procedimentos, à mesma temperatura, a formação do ácido acético:
mais rápida em I porque o ácido acético é liberado na forma de vapor.
mais rápida em II porque em solução a frequência de colisões entre os reagentes é maior.
mais rápida em I porque no estado sólido a concentração dos reagentes é maior.
mais rápida em II porque o ácido acético se dissolve na água.
ocorre em I e II com igual velocidade porque os reagentes são os mesmos.
O tetróxido de dinitrogênio (N2O4) é uma substância usada em larga escala na produção de ácido nítrico. Quando abaixo de 21 ºC apresenta-se no estado líquido sendo decomposto em NO2 de acordo com a reação NÃO-BALANCEADA abaixo:
N2O4(g) --> NO2(g)
Em um balão volumétrico de 1000 mL são introduzidos 5,0 mols de tetróxido de dinitrogênio. Uma vez atingido o equilíbrio, restaram no sistema 1,3 mols deste reagente. Baseado nas informações dadas e na reação de decomposição do N2O4, calcule o valor da constante de equilíbrio (Kc).
32
10
25
42
38
Uma pilha-padrão que é formada por Cu/Cu(NO3)2 e Fe/FeSO4 ,apresenta um potencial igual a 0,78 volt. Conhecendo-se o potencial-padrão de redução de Cu2+ + 2 e – ---> Cu, que é E0 = 0,34 volt, e sabendo-se que o eletrodo de Fe(s) se dissolve, pergunta-se:
Qual é o potencial-padrão de redução de Fe2+ + 2 e – ----> Fe(s)?
I e III estão corretas
II está correta
III está correta
II e IV estão corretas
I está correta
Pesquisas demonstraram a eficiência do óxido nítrico, NO, no tratamento de determinado tipo de doença pulmonar. Sendo facilmente oxidado a NO2, quando preparado em laboratório, o ácido nítrico deve ser recolhido em meio que não contenha oxigênio. Os Nox do nitrogênio no NO e NO2 são, respectivamente:
+ 3 e + 6.
+ 2 e + 2.
+ 2 e + 4.
zero e + 4.
zero e + 2.
De acordo com a equação abaixo é realizada segundo dois procedimentos:
NaHSO4+CH3COONa → CH3COOH + Na2SO4.
I. Triturando reagentes sólidos.
II. Misturando soluções aquosas concentradas dos reagentes.
Qual a alternativa que melhor atende quando se utiliza a mesma quantidade de NaHSO4 e mesma quantidade de CH3COONa nesses procedimentos, à mesma temperatura, a formação do ácido acético:
mais rápida em I porque o ácido acético é liberado na forma de vapor.
mais rápida em II porque em solução a frequência de colisões entre os reagentes é maior.
mais rápida em I porque no estado sólido a concentração dos reagentes é maior.
mais rápida em II porque o ácido acético se dissolve na água.
ocorre em I e II com igual velocidade porque os reagentes são os mesmos.
O tetróxido de dinitrogênio (N2O4) é uma substância usada em larga escala na produção de ácido nítrico. Quando abaixo de 21 ºC apresenta-se no estado líquido sendo decomposto em NO2 de acordo com a reação NÃO-BALANCEADA abaixo:
N2O4(g) --> NO2(g)
Em um balão volumétrico de 1000 mL são introduzidos 5,0 mols de tetróxido de dinitrogênio. Uma vez atingido o equilíbrio, restaram no sistema 1,3 mols deste reagente. Baseado nas informações dadas e na reação de decomposição do N2O4, calcule o valor da constante de equilíbrio (Kc).
32
10
25
42
38
Uma pilha-padrão que é formada por Cu/Cu(NO3)2 e Fe/FeSO4 ,apresenta um potencial igual a 0,78 volt. Conhecendo-se o potencial-padrão de redução de Cu2+ + 2 e – ---> Cu, que é E0 = 0,34 volt, e sabendo-se que o eletrodo de Fe(s) se dissolve, pergunta-se:
Qual é o potencial-padrão de redução de Fe2+ + 2 e – ----> Fe(s)?
+ 3 e + 6.
+ 2 e + 2.
+ 2 e + 4.
zero e + 4.
zero e + 2.
De acordo com a equação abaixo é realizada segundo dois procedimentos:
NaHSO4+CH3COONa → CH3COOH + Na2SO4.
I. Triturando reagentes sólidos.
II. Misturando soluções aquosas concentradas dos reagentes.
Qual a alternativa que melhor atende quando se utiliza a mesma quantidade de NaHSO4 e mesma quantidade de CH3COONa nesses procedimentos, à mesma temperatura, a formação do ácido acético:
mais rápida em I porque o ácido acético é liberado na forma de vapor.
mais rápida em II porque em solução a frequência de colisões entre os reagentes é maior.
mais rápida em I porque no estado sólido a concentração dos reagentes é maior.
mais rápida em II porque o ácido acético se dissolve na água.
ocorre em I e II com igual velocidade porque os reagentes são os mesmos.
O tetróxido de dinitrogênio (N2O4) é uma substância usada em larga escala na produção de ácido nítrico. Quando abaixo de 21 ºC apresenta-se no estado líquido sendo decomposto em NO2 de acordo com a reação NÃO-BALANCEADA abaixo:
N2O4(g) --> NO2(g)
Em um balão volumétrico de 1000 mL são introduzidos 5,0 mols de tetróxido de dinitrogênio. Uma vez atingido o equilíbrio, restaram no sistema 1,3 mols deste reagente. Baseado nas informações dadas e na reação de decomposição do N2O4, calcule o valor da constante de equilíbrio (Kc).
32
10
25
42
38
Uma pilha-padrão que é formada por Cu/Cu(NO3)2 e Fe/FeSO4 ,apresenta um potencial igual a 0,78 volt. Conhecendo-se o potencial-padrão de redução de Cu2+ + 2 e – ---> Cu, que é E0 = 0,34 volt, e sabendo-se que o eletrodo de Fe(s) se dissolve, pergunta-se:
Qual é o potencial-padrão de redução de Fe2+ + 2 e – ----> Fe(s)?
mais rápida em I porque o ácido acético é liberado na forma de vapor.
mais rápida em II porque em solução a frequência de colisões entre os reagentes é maior.
mais rápida em I porque no estado sólido a concentração dos reagentes é maior.
mais rápida em II porque o ácido acético se dissolve na água.
ocorre em I e II com igual velocidade porque os reagentes são os mesmos.
O tetróxido de dinitrogênio (N2O4) é uma substância usada em larga escala na produção de ácido nítrico. Quando abaixo de 21 ºC apresenta-se no estado líquido sendo decomposto em NO2 de acordo com a reação NÃO-BALANCEADA abaixo:
N2O4(g) --> NO2(g)
Em um balão volumétrico de 1000 mL são introduzidos 5,0 mols de tetróxido de dinitrogênio. Uma vez atingido o equilíbrio, restaram no sistema 1,3 mols deste reagente. Baseado nas informações dadas e na reação de decomposição do N2O4, calcule o valor da constante de equilíbrio (Kc).
32
10
25
42
38
Uma pilha-padrão que é formada por Cu/Cu(NO3)2 e Fe/FeSO4 ,apresenta um potencial igual a 0,78 volt. Conhecendo-se o potencial-padrão de redução de Cu2+ + 2 e – ---> Cu, que é E0 = 0,34 volt, e sabendo-se que o eletrodo de Fe(s) se dissolve, pergunta-se:
Qual é o potencial-padrão de redução de Fe2+ + 2 e – ----> Fe(s)?
N2O4(g) --> NO2(g)
Em um balão volumétrico de 1000 mL são introduzidos 5,0 mols de tetróxido de dinitrogênio. Uma vez atingido o equilíbrio, restaram no sistema 1,3 mols deste reagente. Baseado nas informações dadas e na reação de decomposição do N2O4, calcule o valor da constante de equilíbrio (Kc).
32
10
25
42
38
Uma pilha-padrão que é formada por Cu/Cu(NO3)2 e Fe/FeSO4 ,apresenta um potencial igual a 0,78 volt. Conhecendo-se o potencial-padrão de redução de Cu2+ + 2 e – ---> Cu, que é E0 = 0,34 volt, e sabendo-se que o eletrodo de Fe(s) se dissolve, pergunta-se:
Qual é o potencial-padrão de redução de Fe2+ + 2 e – ----> Fe(s)?
Qual é o potencial-padrão de redução de Fe2+ + 2 e – ----> Fe(s)?