ESTUDOS INTERDISCIPLINARES EM QUÍMICA
Água é vida, porém água sem tratamento pode causar doenças graves. Como nem toda a água presente na natureza está em condições para consumo imediato, a água deverá passar por um tratamento até que se encontre em condições de consumo e seja classificada como água potável.
A qualidade da água bruta, extraída de águas superficiais ou subterrâneas, varia amplamente, assim como também variam os tipos e as quantidades de poluentes nela contidos. Um dos processos de tratamento para obtenção de água potável está esquematizado na figura abaixo.

Analisando a figura, pode-se concluir que a função cloro no processo consiste em
promover a biorremediação da água.
remover a dureza da água.
eliminar microorganismos patogênicos.
remover gases dissolvidos responsáveis pelo odor da água.
precipitar colóides presentes na água.
Para avaliar a eficiência do tratamento de resíduos de efluentes domésticos, pode-se quantificar o teor de nitrogênio total e de suas diferentes frações, como nitrogênio amoniacal, nitratos e nitritos. A determinação do nitrogênio total orgânico é realizada pelo processo de Kjeldahl. O método baseia-se na digestão da amostra com ácido sulfúrico concentrado. Para amostras com elevado teor de matéria orgânica, a amostra sólida ou semissólida é tratada com ácido sulfúrico na presença de sulfato de potássio e um catalizador, além da adição de peróxido de hidrogênio para garantir total mineralização dela. A mineralização resulta na formação de água, dióxido de carbono e amônia. A amônia é fixada pelo ácido sulfúrico na forma de sulfato de amônio, sendo posteriormente destilada pela adição de uma base forte e recolhida em excesso de ácido sulfúrico.
Visando avaliar o tratamento de resíduos de efluentes domésticos de certa estação, procedeu-se à conversão, em amônia, de todo nitrogênio contido em uma amostra de 0,500 g de biossólido, retirada após tratamento realizado na estação. A amônia foi recolhida em 50 mL de uma solução de ácido sulfúrico 0,1 mol/L, sendo que o excesso de solução de ácido sulfúrico consumiu 10 mL de uma solução de NaOH 0,2 mol/L. Considerando que N = 14; H = 1; O = 16; S = 32, o teor total de nitrogênio nessa amostra é de:
(NH4)2SO4 + 2NaOH → Na2SO4 + 2NH3 + H2O
NH3 + H3BO3 → NH4H2BO3-
2NH4H2BO3- + H2SO4 → (NH4)2SO4 + 2H2BO3
H2SO4 + 2NaOH → Na2SO4 + 2H2O
11,2%
26,4%
5,60%
22,4%
25%
Para se evitar a indução ao erro, o transporte, o armazenamento, o manuseio e o descarte de produtos químicos devem ser executados sob regras rigorosas de segurança. Com relação ao soro fisiológico e à vaselina líquida, substâncias visualmente semelhantes, analise as afirmações abaixo.
I. Os frascos desses reagentes podem ser utilizados, desde que o rótulo seja completamente retirado e o frasco seja lavado com água (deve-se proceder à lavagem tríplice com o menor volume de água possível, e a água de lavagem dos frascos deve ser considerada resíduo da substância contida no mesmo).
II. A vaselina líquida e o soro fisiológico glicosado podem ser guardados no mesmo armário, desde que fiquem em compartimentos separados de acordo com suas funções químicas e estejam, cada um, em frascos, porém não há necessidade de utilização de etiquetas, pois não são considerados reagentes tóxicos.
III. Tanto a vaselina líquida quanto o soro fisiológico não podem ser descartados em esgotos, bueiros ou qualquer outro corpo d’água, a fim de se prevenir a contaminação dos cursos pluviais.
IV. A leitura atenta de rótulos de reagentes antes de usá-los é um princípio de segurança fundamental que deve ser adotado pelos profissionais que manipulam esses produtos.
É correto apenas o que se afirma em
I e III
II e IV
II e III
I e IV
III e IV
Os carbonatos resultam da combinação do CO32- com metais e metalóides, ou da reação do ácido carbônico com esses elementos. Os carbonatos de metais alcalinos e alcalino-terrosos podem ser obtidos a partir de seus óxidos, conforme a equação abaixo:
MxO(s) + CO2(g) → MxCO3(s), para M = Na, K, Ca e Mg
A variação de energia livre dessas reações permite estabelecer uma escala de basicidade dos óxidos, conforme proposto por Flood e Förland. Os óxidos de metais alcalinos são em geral bases mais fortes do que os de alcalino-terrosos e, em cada grupo, a basicidade do óxido aumenta com o tamanho do metal. Isto se justifica porque a interação do cátion M+ com o íon O2- é mais fraca do que no caso de um cátion M2+ e também é mais fraca para cátions maiores, resultando um óxido com maior facilidade de ceder o íon O2-para um óxido ácido. A ordem de caráter ácido-básico de alguns óxidos é mostrada abaixo:
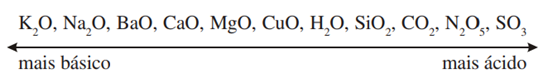
Sendo assim, quanto mais afastados estiverem dois óxidos nessa série, mais estável será o composto formado quando os óxidos reagirem entre si.
O diagrama a seguir apresenta os valores da energia de Gibbs padrão (ΔG°) para a formação de alguns destes carbonatos, em função da temperatura.
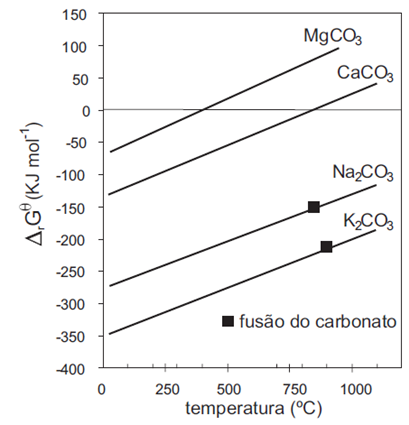
(MAIA & OSÓRIO. Quim. Nova, 26(4), 2003)
Com base neste diagrama, é correto afirmar que:
os carbonatos de metais alcalinos são mais estáveis que os de metais alcalino-terrosos.
a entalpia de formação dos carbonatos é negativa.
o carbonato de cálcio se decompõe espontaneamente acima de 400°C.
a formação dos carbonatos é favorecida pelo aumento de temperatura.
a entropia de formação dos carbonatos é positiva.
O ozônio tem grande importância nos processos que ocorrem na troposfera. Um mecanismo proposto para a sua decomposição na atmosfera, na ausência de poluentes, é apresentado a seguir.
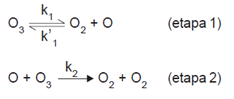
Alguns processos químicos ocorrem em várias etapas. As reações globais são as que ocorrem em mais de uma etapa. A velocidade desta reação depende da velocidade das etapas participantes. Quando isto acontecer, determina-se a velocidade da reação através da etapa lenta.
Considerando que a etapa lenta do processo é a 2, qual é a relação de dependência existente entre a velocidade de decomposição do ozônio e as concentrações das espécies envolvidas?
A velocidade é diretamente proporcional à concentração de O2.
A velocidade é inversamente proporcional à concentração de O3.
A velocidade é inversamente proporcional à concentração de O2.
A velocidade é diretamente proporcional à concentração de O3.
A velocidade não depende da concentração de O2.
A termodinâmica é uma ciência experimental, pois a partir da observação de alguns fenômenos físico-químicos foram elaboradas leis básicas, conhecidas como a Lei Zero, a Primeira, a Segunda e a Terceira Leis da Termodinâmica. Está ciência é a área da Química que se dedica ao estudo das transformações de energia e o entendimento da primeira lei da termodinâmica envolve a compreensão de algumas formas de energia, tais como o calor e trabalho.
A respeito da primeira lei da termodinâmica, avalie as afirmações a seguir.
- A energia interna permanece constante independente de qual seja o sistema de estudo.
- Em um processo de expansão livre em que não há trocas de calor com a vizinhança, a energia interna do sistema diminui.
- A variação de energia interna de um sistema fechado é igual à energia transferida como calor ou trabalho através de suas fronteiras.
- Para processos adiabáticos, a variação da energia interna está associada ao trabalho realizado pelo sistema ou sobre o sistema.
É correto apenas o que se afirma em:
I, II e IV
I e II
II e III
III e IV
I, III e IV
Reações com energia livre de Gibbs negativo liberam energia livre e são chamadas de reações exergônicas, o que significa que os reagentes, têm mais energia livre que os produtos. Já em reações com energia livre de Gibbs positivo, por sua vez, precisam de entrada de energia e são chamadas de reações endergônicas, o que significa que os produtos, têm mais energia livre que os reagentes
Os gráficos abaixo representam valores de Energia livre de Gibbs, de acordo com a extensão da reação, em três situações distintas.
 Com relação a esse tema, assinale a opção que descreve corretamente o comportamento representado em cada um dos gráficos acima.
Com relação a esse tema, assinale a opção que descreve corretamente o comportamento representado em cada um dos gráficos acima.
No gráfico I, a reação não é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico II, a reação é espontânea e os produtos são favorecidos em relação aos reagentes; no gráfico III, os produtos e os reagentes são favorecidos de forma aproximada.
No gráfico I, a reação é espontânea e os produtos são favorecidos em relação aos reagentes; no gráfico II, a reação não é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico III, os produtos e os reagentes são igualmente favorecidos.
No gráfico I, a reação é endotérmica e os produtos são favorecidos em relação aos reagentes; no gráfico II, a reação é exotérmica e os reagentes são favorecidos em relação aos produtos; no gráfico III, a reação não é espontânea e os produtos são favorecidos em relação aos reagentes.
No gráfico I, a reação não está em equilíbrio e os reagentes são favorecidos em relação aos produtos; no gráfico II, areação não é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico III, a reação é espontânea e os produtos e reagentes são igualmente favorecidos.
No gráfico I, a reação não é espontânea e os produtos são favorecidos em relação aos reagentes; no gráfico II, a reação é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico III, os produtos são favorecidos em relação aos reagentes.
O etanol é um combustível produzido a partir de fontes renováveis e, ao ser utilizado como aditivo da gasolina, reduz as emissões de gases de efeito estufa. Essas duas características lhe dão importância estratégica no combate à intensificação do efeito estufa e seus efeitos nas mudanças climáticas globais e colocam o produto em linha com os princípios do desenvolvimento sustentável. Para ser usado como tal, o processo de combustão do etanol deve ser exotérmico e pouco poluente. A reação da combustão desse combustível é dada pela reação não balanceada a seguir:
C2H6O + O2 → CO2 + H2O
ÚNICA. Produção e uso do etanol no Brasil. Disponível em: . Acesso em: 7 set. 2011.
A tabela a seguir traz informações sobre as energias, em termos de entalpia, das ligações envolvidas na reação química de combustão do etanol.

Com base nessas informações, analise as afirmações que se seguem.
I. A energia envolvida na quebra das ligações C–H é +2 155 kJ.
II. A energia envolvida na quebra das ligações O=O é +1 482 kJ.
III. A energia envolvida na formação das ligações C=O é -3 196 kJ.
IV. A energia envolvida na formação das ligações O–H é -918 kJ.
É correto apenas o que se afirma em:
II e IV
I e IV
II e III
III
I
Os coloides, ou também chamados sistemas coloidais, são sistemas que apresentam um ou mais componentes possuindo dimensões entre 1 nm a 1 µm. Podemos citar como exemplos de sistemas coloidais o mel, gelatina, maionese, sangue, etc., muitos deles sendo confundidos, erroneamente, com soluções.
Um exemplo claro desse erro de análise ocorre quando misturamos detergente à água, formando um sistema coloidal. Analisando mais profundamente a química dos coloides, podemos afirmar corretamente que:
as micelas são muito pequenas para serem vistas a olho nú e, por conta disso, não promovem o espalhamento da luz.
dispersões coloidais são mantidas estáveis, devido às atrações eletrostáticas que ocorrem entre a superfície das partículas coloidais.
uma maneira prática de diferenciar uma solução de uma dispersão coloidal é por meio do efeito Tyndall, observado somente em soluções.
em meio aquoso, a porção hidrofílica das moléculas de detergente orientam-se na parte interna das micelas.
as partículas de coloides podem ser formadas tanto por agregados de moléculas, como por macromoléculas dispersas.
Durante o acompanhamento da quantidade de matéria orgânica em um córrego, resultados de análises de amostras de 100 mL de água, recolhidas, ao longo de três meses, comprovaram a presença de, em média, 3,2 mg de matéria orgânica, na forma de glicose C6H12O6 (massa molar é 180 g/mol).
Com base nessas análises, 5 pareceres foram elaborados, por pessoas diferente:
P1: A qualidade da água tornou-se inadequada para sustentar a vida aquática e, nas atuais condições, apenas cerca de 25% da matéria orgânica pode ser decomposto.
P2: A qualidade da água do rio ainda é boa, uma vez que cerca de três quartos da matéria orgânica podem ser decompostos.
P3: Nas condições atuais, no máximo, 50% da matéria orgânica pode ser decomposto, e a manutenção da vida aquática fica comprometida.
P4: A qualidade da água do rio é boa. Há oxigênio na água suficiente para degradar toda a matéria orgânica e manter a vida aquática.
P5: A quantidade de matéria orgânica precisa ser reduzida a, aproximadamente, 2% dos níveis atuais para poder sustentar a vida aquática.
Ao analisar os relatórios, um químico levou em consideração os seguintes pontos:
a concentração mínima de O2 na água para sustentar a vida aquática é de 5 ppm, à temperatura média de 200 C;
a solubilidade do oxigênio em rios depende de vários fatores, mas para cálculos mais simples pode ser considerada igual a solubilidade do O2 em água, que é de 9 ppm, a 200 C e 1 atm.
Com base nesses ponto, o químico recomendou o relatório:
promover a biorremediação da água.
remover a dureza da água.
eliminar microorganismos patogênicos.
remover gases dissolvidos responsáveis pelo odor da água.
precipitar colóides presentes na água.
Para avaliar a eficiência do tratamento de resíduos de efluentes domésticos, pode-se quantificar o teor de nitrogênio total e de suas diferentes frações, como nitrogênio amoniacal, nitratos e nitritos. A determinação do nitrogênio total orgânico é realizada pelo processo de Kjeldahl. O método baseia-se na digestão da amostra com ácido sulfúrico concentrado. Para amostras com elevado teor de matéria orgânica, a amostra sólida ou semissólida é tratada com ácido sulfúrico na presença de sulfato de potássio e um catalizador, além da adição de peróxido de hidrogênio para garantir total mineralização dela. A mineralização resulta na formação de água, dióxido de carbono e amônia. A amônia é fixada pelo ácido sulfúrico na forma de sulfato de amônio, sendo posteriormente destilada pela adição de uma base forte e recolhida em excesso de ácido sulfúrico.
Visando avaliar o tratamento de resíduos de efluentes domésticos de certa estação, procedeu-se à conversão, em amônia, de todo nitrogênio contido em uma amostra de 0,500 g de biossólido, retirada após tratamento realizado na estação. A amônia foi recolhida em 50 mL de uma solução de ácido sulfúrico 0,1 mol/L, sendo que o excesso de solução de ácido sulfúrico consumiu 10 mL de uma solução de NaOH 0,2 mol/L. Considerando que N = 14; H = 1; O = 16; S = 32, o teor total de nitrogênio nessa amostra é de:
(NH4)2SO4 + 2NaOH → Na2SO4 + 2NH3 + H2O
NH3 + H3BO3 → NH4H2BO3-
2NH4H2BO3- + H2SO4 → (NH4)2SO4 + 2H2BO3
H2SO4 + 2NaOH → Na2SO4 + 2H2O
11,2%
26,4%
5,60%
22,4%
25%
Para se evitar a indução ao erro, o transporte, o armazenamento, o manuseio e o descarte de produtos químicos devem ser executados sob regras rigorosas de segurança. Com relação ao soro fisiológico e à vaselina líquida, substâncias visualmente semelhantes, analise as afirmações abaixo.
I. Os frascos desses reagentes podem ser utilizados, desde que o rótulo seja completamente retirado e o frasco seja lavado com água (deve-se proceder à lavagem tríplice com o menor volume de água possível, e a água de lavagem dos frascos deve ser considerada resíduo da substância contida no mesmo).
II. A vaselina líquida e o soro fisiológico glicosado podem ser guardados no mesmo armário, desde que fiquem em compartimentos separados de acordo com suas funções químicas e estejam, cada um, em frascos, porém não há necessidade de utilização de etiquetas, pois não são considerados reagentes tóxicos.
III. Tanto a vaselina líquida quanto o soro fisiológico não podem ser descartados em esgotos, bueiros ou qualquer outro corpo d’água, a fim de se prevenir a contaminação dos cursos pluviais.
IV. A leitura atenta de rótulos de reagentes antes de usá-los é um princípio de segurança fundamental que deve ser adotado pelos profissionais que manipulam esses produtos.
É correto apenas o que se afirma em
I e III
II e IV
II e III
I e IV
III e IV
Os carbonatos resultam da combinação do CO32- com metais e metalóides, ou da reação do ácido carbônico com esses elementos. Os carbonatos de metais alcalinos e alcalino-terrosos podem ser obtidos a partir de seus óxidos, conforme a equação abaixo:
MxO(s) + CO2(g) → MxCO3(s), para M = Na, K, Ca e Mg
A variação de energia livre dessas reações permite estabelecer uma escala de basicidade dos óxidos, conforme proposto por Flood e Förland. Os óxidos de metais alcalinos são em geral bases mais fortes do que os de alcalino-terrosos e, em cada grupo, a basicidade do óxido aumenta com o tamanho do metal. Isto se justifica porque a interação do cátion M+ com o íon O2- é mais fraca do que no caso de um cátion M2+ e também é mais fraca para cátions maiores, resultando um óxido com maior facilidade de ceder o íon O2-para um óxido ácido. A ordem de caráter ácido-básico de alguns óxidos é mostrada abaixo:
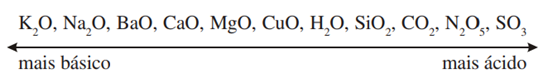
Sendo assim, quanto mais afastados estiverem dois óxidos nessa série, mais estável será o composto formado quando os óxidos reagirem entre si.
O diagrama a seguir apresenta os valores da energia de Gibbs padrão (ΔG°) para a formação de alguns destes carbonatos, em função da temperatura.

(MAIA & OSÓRIO. Quim. Nova, 26(4), 2003)
Com base neste diagrama, é correto afirmar que:
os carbonatos de metais alcalinos são mais estáveis que os de metais alcalino-terrosos.
a entalpia de formação dos carbonatos é negativa.
o carbonato de cálcio se decompõe espontaneamente acima de 400°C.
a formação dos carbonatos é favorecida pelo aumento de temperatura.
a entropia de formação dos carbonatos é positiva.
O ozônio tem grande importância nos processos que ocorrem na troposfera. Um mecanismo proposto para a sua decomposição na atmosfera, na ausência de poluentes, é apresentado a seguir.
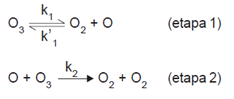
Alguns processos químicos ocorrem em várias etapas. As reações globais são as que ocorrem em mais de uma etapa. A velocidade desta reação depende da velocidade das etapas participantes. Quando isto acontecer, determina-se a velocidade da reação através da etapa lenta.
Considerando que a etapa lenta do processo é a 2, qual é a relação de dependência existente entre a velocidade de decomposição do ozônio e as concentrações das espécies envolvidas?
A velocidade é diretamente proporcional à concentração de O2.
A velocidade é inversamente proporcional à concentração de O3.
A velocidade é inversamente proporcional à concentração de O2.
A velocidade é diretamente proporcional à concentração de O3.
A velocidade não depende da concentração de O2.
A termodinâmica é uma ciência experimental, pois a partir da observação de alguns fenômenos físico-químicos foram elaboradas leis básicas, conhecidas como a Lei Zero, a Primeira, a Segunda e a Terceira Leis da Termodinâmica. Está ciência é a área da Química que se dedica ao estudo das transformações de energia e o entendimento da primeira lei da termodinâmica envolve a compreensão de algumas formas de energia, tais como o calor e trabalho.
A respeito da primeira lei da termodinâmica, avalie as afirmações a seguir.
- A energia interna permanece constante independente de qual seja o sistema de estudo.
- Em um processo de expansão livre em que não há trocas de calor com a vizinhança, a energia interna do sistema diminui.
- A variação de energia interna de um sistema fechado é igual à energia transferida como calor ou trabalho através de suas fronteiras.
- Para processos adiabáticos, a variação da energia interna está associada ao trabalho realizado pelo sistema ou sobre o sistema.
É correto apenas o que se afirma em:
I, II e IV
I e II
II e III
III e IV
I, III e IV
Reações com energia livre de Gibbs negativo liberam energia livre e são chamadas de reações exergônicas, o que significa que os reagentes, têm mais energia livre que os produtos. Já em reações com energia livre de Gibbs positivo, por sua vez, precisam de entrada de energia e são chamadas de reações endergônicas, o que significa que os produtos, têm mais energia livre que os reagentes
Os gráficos abaixo representam valores de Energia livre de Gibbs, de acordo com a extensão da reação, em três situações distintas.
 Com relação a esse tema, assinale a opção que descreve corretamente o comportamento representado em cada um dos gráficos acima.
Com relação a esse tema, assinale a opção que descreve corretamente o comportamento representado em cada um dos gráficos acima.
No gráfico I, a reação não é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico II, a reação é espontânea e os produtos são favorecidos em relação aos reagentes; no gráfico III, os produtos e os reagentes são favorecidos de forma aproximada.
No gráfico I, a reação é espontânea e os produtos são favorecidos em relação aos reagentes; no gráfico II, a reação não é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico III, os produtos e os reagentes são igualmente favorecidos.
No gráfico I, a reação é endotérmica e os produtos são favorecidos em relação aos reagentes; no gráfico II, a reação é exotérmica e os reagentes são favorecidos em relação aos produtos; no gráfico III, a reação não é espontânea e os produtos são favorecidos em relação aos reagentes.
No gráfico I, a reação não está em equilíbrio e os reagentes são favorecidos em relação aos produtos; no gráfico II, areação não é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico III, a reação é espontânea e os produtos e reagentes são igualmente favorecidos.
No gráfico I, a reação não é espontânea e os produtos são favorecidos em relação aos reagentes; no gráfico II, a reação é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico III, os produtos são favorecidos em relação aos reagentes.
O etanol é um combustível produzido a partir de fontes renováveis e, ao ser utilizado como aditivo da gasolina, reduz as emissões de gases de efeito estufa. Essas duas características lhe dão importância estratégica no combate à intensificação do efeito estufa e seus efeitos nas mudanças climáticas globais e colocam o produto em linha com os princípios do desenvolvimento sustentável. Para ser usado como tal, o processo de combustão do etanol deve ser exotérmico e pouco poluente. A reação da combustão desse combustível é dada pela reação não balanceada a seguir:
C2H6O + O2 → CO2 + H2O
ÚNICA. Produção e uso do etanol no Brasil. Disponível em: . Acesso em: 7 set. 2011.
A tabela a seguir traz informações sobre as energias, em termos de entalpia, das ligações envolvidas na reação química de combustão do etanol.

Com base nessas informações, analise as afirmações que se seguem.
I. A energia envolvida na quebra das ligações C–H é +2 155 kJ.
II. A energia envolvida na quebra das ligações O=O é +1 482 kJ.
III. A energia envolvida na formação das ligações C=O é -3 196 kJ.
IV. A energia envolvida na formação das ligações O–H é -918 kJ.
É correto apenas o que se afirma em:
II e IV
I e IV
II e III
III
I
Os coloides, ou também chamados sistemas coloidais, são sistemas que apresentam um ou mais componentes possuindo dimensões entre 1 nm a 1 µm. Podemos citar como exemplos de sistemas coloidais o mel, gelatina, maionese, sangue, etc., muitos deles sendo confundidos, erroneamente, com soluções.
Um exemplo claro desse erro de análise ocorre quando misturamos detergente à água, formando um sistema coloidal. Analisando mais profundamente a química dos coloides, podemos afirmar corretamente que:
as micelas são muito pequenas para serem vistas a olho nú e, por conta disso, não promovem o espalhamento da luz.
dispersões coloidais são mantidas estáveis, devido às atrações eletrostáticas que ocorrem entre a superfície das partículas coloidais.
uma maneira prática de diferenciar uma solução de uma dispersão coloidal é por meio do efeito Tyndall, observado somente em soluções.
em meio aquoso, a porção hidrofílica das moléculas de detergente orientam-se na parte interna das micelas.
as partículas de coloides podem ser formadas tanto por agregados de moléculas, como por macromoléculas dispersas.
Durante o acompanhamento da quantidade de matéria orgânica em um córrego, resultados de análises de amostras de 100 mL de água, recolhidas, ao longo de três meses, comprovaram a presença de, em média, 3,2 mg de matéria orgânica, na forma de glicose C6H12O6 (massa molar é 180 g/mol).
Com base nessas análises, 5 pareceres foram elaborados, por pessoas diferente:
P1: A qualidade da água tornou-se inadequada para sustentar a vida aquática e, nas atuais condições, apenas cerca de 25% da matéria orgânica pode ser decomposto.
P2: A qualidade da água do rio ainda é boa, uma vez que cerca de três quartos da matéria orgânica podem ser decompostos.
P3: Nas condições atuais, no máximo, 50% da matéria orgânica pode ser decomposto, e a manutenção da vida aquática fica comprometida.
P4: A qualidade da água do rio é boa. Há oxigênio na água suficiente para degradar toda a matéria orgânica e manter a vida aquática.
P5: A quantidade de matéria orgânica precisa ser reduzida a, aproximadamente, 2% dos níveis atuais para poder sustentar a vida aquática.
Ao analisar os relatórios, um químico levou em consideração os seguintes pontos:
a concentração mínima de O2 na água para sustentar a vida aquática é de 5 ppm, à temperatura média de 200 C;
a solubilidade do oxigênio em rios depende de vários fatores, mas para cálculos mais simples pode ser considerada igual a solubilidade do O2 em água, que é de 9 ppm, a 200 C e 1 atm.
Com base nesses ponto, o químico recomendou o relatório:
11,2%
26,4%
5,60%
22,4%
25%
Para se evitar a indução ao erro, o transporte, o armazenamento, o manuseio e o descarte de produtos químicos devem ser executados sob regras rigorosas de segurança. Com relação ao soro fisiológico e à vaselina líquida, substâncias visualmente semelhantes, analise as afirmações abaixo.
I. Os frascos desses reagentes podem ser utilizados, desde que o rótulo seja completamente retirado e o frasco seja lavado com água (deve-se proceder à lavagem tríplice com o menor volume de água possível, e a água de lavagem dos frascos deve ser considerada resíduo da substância contida no mesmo).
II. A vaselina líquida e o soro fisiológico glicosado podem ser guardados no mesmo armário, desde que fiquem em compartimentos separados de acordo com suas funções químicas e estejam, cada um, em frascos, porém não há necessidade de utilização de etiquetas, pois não são considerados reagentes tóxicos.
III. Tanto a vaselina líquida quanto o soro fisiológico não podem ser descartados em esgotos, bueiros ou qualquer outro corpo d’água, a fim de se prevenir a contaminação dos cursos pluviais.
IV. A leitura atenta de rótulos de reagentes antes de usá-los é um princípio de segurança fundamental que deve ser adotado pelos profissionais que manipulam esses produtos.
É correto apenas o que se afirma em
I e III
II e IV
II e III
I e IV
III e IV
Os carbonatos resultam da combinação do CO32- com metais e metalóides, ou da reação do ácido carbônico com esses elementos. Os carbonatos de metais alcalinos e alcalino-terrosos podem ser obtidos a partir de seus óxidos, conforme a equação abaixo:
MxO(s) + CO2(g) → MxCO3(s), para M = Na, K, Ca e Mg
A variação de energia livre dessas reações permite estabelecer uma escala de basicidade dos óxidos, conforme proposto por Flood e Förland. Os óxidos de metais alcalinos são em geral bases mais fortes do que os de alcalino-terrosos e, em cada grupo, a basicidade do óxido aumenta com o tamanho do metal. Isto se justifica porque a interação do cátion M+ com o íon O2- é mais fraca do que no caso de um cátion M2+ e também é mais fraca para cátions maiores, resultando um óxido com maior facilidade de ceder o íon O2-para um óxido ácido. A ordem de caráter ácido-básico de alguns óxidos é mostrada abaixo:
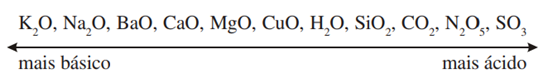
Sendo assim, quanto mais afastados estiverem dois óxidos nessa série, mais estável será o composto formado quando os óxidos reagirem entre si.
O diagrama a seguir apresenta os valores da energia de Gibbs padrão (ΔG°) para a formação de alguns destes carbonatos, em função da temperatura.

(MAIA & OSÓRIO. Quim. Nova, 26(4), 2003)
Com base neste diagrama, é correto afirmar que:
os carbonatos de metais alcalinos são mais estáveis que os de metais alcalino-terrosos.
a entalpia de formação dos carbonatos é negativa.
o carbonato de cálcio se decompõe espontaneamente acima de 400°C.
a formação dos carbonatos é favorecida pelo aumento de temperatura.
a entropia de formação dos carbonatos é positiva.
O ozônio tem grande importância nos processos que ocorrem na troposfera. Um mecanismo proposto para a sua decomposição na atmosfera, na ausência de poluentes, é apresentado a seguir.
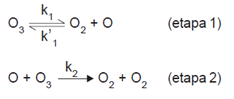
Alguns processos químicos ocorrem em várias etapas. As reações globais são as que ocorrem em mais de uma etapa. A velocidade desta reação depende da velocidade das etapas participantes. Quando isto acontecer, determina-se a velocidade da reação através da etapa lenta.
Considerando que a etapa lenta do processo é a 2, qual é a relação de dependência existente entre a velocidade de decomposição do ozônio e as concentrações das espécies envolvidas?
A velocidade é diretamente proporcional à concentração de O2.
A velocidade é inversamente proporcional à concentração de O3.
A velocidade é inversamente proporcional à concentração de O2.
A velocidade é diretamente proporcional à concentração de O3.
A velocidade não depende da concentração de O2.
A termodinâmica é uma ciência experimental, pois a partir da observação de alguns fenômenos físico-químicos foram elaboradas leis básicas, conhecidas como a Lei Zero, a Primeira, a Segunda e a Terceira Leis da Termodinâmica. Está ciência é a área da Química que se dedica ao estudo das transformações de energia e o entendimento da primeira lei da termodinâmica envolve a compreensão de algumas formas de energia, tais como o calor e trabalho.
A respeito da primeira lei da termodinâmica, avalie as afirmações a seguir.
- A energia interna permanece constante independente de qual seja o sistema de estudo.
- Em um processo de expansão livre em que não há trocas de calor com a vizinhança, a energia interna do sistema diminui.
- A variação de energia interna de um sistema fechado é igual à energia transferida como calor ou trabalho através de suas fronteiras.
- Para processos adiabáticos, a variação da energia interna está associada ao trabalho realizado pelo sistema ou sobre o sistema.
É correto apenas o que se afirma em:
I, II e IV
I e II
II e III
III e IV
I, III e IV
Reações com energia livre de Gibbs negativo liberam energia livre e são chamadas de reações exergônicas, o que significa que os reagentes, têm mais energia livre que os produtos. Já em reações com energia livre de Gibbs positivo, por sua vez, precisam de entrada de energia e são chamadas de reações endergônicas, o que significa que os produtos, têm mais energia livre que os reagentes
Os gráficos abaixo representam valores de Energia livre de Gibbs, de acordo com a extensão da reação, em três situações distintas.
 Com relação a esse tema, assinale a opção que descreve corretamente o comportamento representado em cada um dos gráficos acima.
Com relação a esse tema, assinale a opção que descreve corretamente o comportamento representado em cada um dos gráficos acima.
No gráfico I, a reação não é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico II, a reação é espontânea e os produtos são favorecidos em relação aos reagentes; no gráfico III, os produtos e os reagentes são favorecidos de forma aproximada.
No gráfico I, a reação é espontânea e os produtos são favorecidos em relação aos reagentes; no gráfico II, a reação não é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico III, os produtos e os reagentes são igualmente favorecidos.
No gráfico I, a reação é endotérmica e os produtos são favorecidos em relação aos reagentes; no gráfico II, a reação é exotérmica e os reagentes são favorecidos em relação aos produtos; no gráfico III, a reação não é espontânea e os produtos são favorecidos em relação aos reagentes.
No gráfico I, a reação não está em equilíbrio e os reagentes são favorecidos em relação aos produtos; no gráfico II, areação não é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico III, a reação é espontânea e os produtos e reagentes são igualmente favorecidos.
No gráfico I, a reação não é espontânea e os produtos são favorecidos em relação aos reagentes; no gráfico II, a reação é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico III, os produtos são favorecidos em relação aos reagentes.
O etanol é um combustível produzido a partir de fontes renováveis e, ao ser utilizado como aditivo da gasolina, reduz as emissões de gases de efeito estufa. Essas duas características lhe dão importância estratégica no combate à intensificação do efeito estufa e seus efeitos nas mudanças climáticas globais e colocam o produto em linha com os princípios do desenvolvimento sustentável. Para ser usado como tal, o processo de combustão do etanol deve ser exotérmico e pouco poluente. A reação da combustão desse combustível é dada pela reação não balanceada a seguir:
C2H6O + O2 → CO2 + H2O
ÚNICA. Produção e uso do etanol no Brasil. Disponível em: . Acesso em: 7 set. 2011.
A tabela a seguir traz informações sobre as energias, em termos de entalpia, das ligações envolvidas na reação química de combustão do etanol.

Com base nessas informações, analise as afirmações que se seguem.
I. A energia envolvida na quebra das ligações C–H é +2 155 kJ.
II. A energia envolvida na quebra das ligações O=O é +1 482 kJ.
III. A energia envolvida na formação das ligações C=O é -3 196 kJ.
IV. A energia envolvida na formação das ligações O–H é -918 kJ.
É correto apenas o que se afirma em:
II e IV
I e IV
II e III
III
I
Os coloides, ou também chamados sistemas coloidais, são sistemas que apresentam um ou mais componentes possuindo dimensões entre 1 nm a 1 µm. Podemos citar como exemplos de sistemas coloidais o mel, gelatina, maionese, sangue, etc., muitos deles sendo confundidos, erroneamente, com soluções.
Um exemplo claro desse erro de análise ocorre quando misturamos detergente à água, formando um sistema coloidal. Analisando mais profundamente a química dos coloides, podemos afirmar corretamente que:
as micelas são muito pequenas para serem vistas a olho nú e, por conta disso, não promovem o espalhamento da luz.
dispersões coloidais são mantidas estáveis, devido às atrações eletrostáticas que ocorrem entre a superfície das partículas coloidais.
uma maneira prática de diferenciar uma solução de uma dispersão coloidal é por meio do efeito Tyndall, observado somente em soluções.
em meio aquoso, a porção hidrofílica das moléculas de detergente orientam-se na parte interna das micelas.
as partículas de coloides podem ser formadas tanto por agregados de moléculas, como por macromoléculas dispersas.
Durante o acompanhamento da quantidade de matéria orgânica em um córrego, resultados de análises de amostras de 100 mL de água, recolhidas, ao longo de três meses, comprovaram a presença de, em média, 3,2 mg de matéria orgânica, na forma de glicose C6H12O6 (massa molar é 180 g/mol).
Com base nessas análises, 5 pareceres foram elaborados, por pessoas diferente:
P1: A qualidade da água tornou-se inadequada para sustentar a vida aquática e, nas atuais condições, apenas cerca de 25% da matéria orgânica pode ser decomposto.
P2: A qualidade da água do rio ainda é boa, uma vez que cerca de três quartos da matéria orgânica podem ser decompostos.
P3: Nas condições atuais, no máximo, 50% da matéria orgânica pode ser decomposto, e a manutenção da vida aquática fica comprometida.
P4: A qualidade da água do rio é boa. Há oxigênio na água suficiente para degradar toda a matéria orgânica e manter a vida aquática.
P5: A quantidade de matéria orgânica precisa ser reduzida a, aproximadamente, 2% dos níveis atuais para poder sustentar a vida aquática.
Ao analisar os relatórios, um químico levou em consideração os seguintes pontos:
a concentração mínima de O2 na água para sustentar a vida aquática é de 5 ppm, à temperatura média de 200 C;
a solubilidade do oxigênio em rios depende de vários fatores, mas para cálculos mais simples pode ser considerada igual a solubilidade do O2 em água, que é de 9 ppm, a 200 C e 1 atm.
Com base nesses ponto, o químico recomendou o relatório:
I e III
II e IV
II e III
I e IV
III e IV
Os carbonatos resultam da combinação do CO32- com metais e metalóides, ou da reação do ácido carbônico com esses elementos. Os carbonatos de metais alcalinos e alcalino-terrosos podem ser obtidos a partir de seus óxidos, conforme a equação abaixo:
MxO(s) + CO2(g) → MxCO3(s), para M = Na, K, Ca e Mg
A variação de energia livre dessas reações permite estabelecer uma escala de basicidade dos óxidos, conforme proposto por Flood e Förland. Os óxidos de metais alcalinos são em geral bases mais fortes do que os de alcalino-terrosos e, em cada grupo, a basicidade do óxido aumenta com o tamanho do metal. Isto se justifica porque a interação do cátion M+ com o íon O2- é mais fraca do que no caso de um cátion M2+ e também é mais fraca para cátions maiores, resultando um óxido com maior facilidade de ceder o íon O2-para um óxido ácido. A ordem de caráter ácido-básico de alguns óxidos é mostrada abaixo:
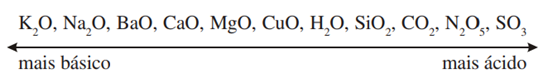
Sendo assim, quanto mais afastados estiverem dois óxidos nessa série, mais estável será o composto formado quando os óxidos reagirem entre si.
O diagrama a seguir apresenta os valores da energia de Gibbs padrão (ΔG°) para a formação de alguns destes carbonatos, em função da temperatura.

(MAIA & OSÓRIO. Quim. Nova, 26(4), 2003)
Com base neste diagrama, é correto afirmar que:
os carbonatos de metais alcalinos são mais estáveis que os de metais alcalino-terrosos.
a entalpia de formação dos carbonatos é negativa.
o carbonato de cálcio se decompõe espontaneamente acima de 400°C.
a formação dos carbonatos é favorecida pelo aumento de temperatura.
a entropia de formação dos carbonatos é positiva.
O ozônio tem grande importância nos processos que ocorrem na troposfera. Um mecanismo proposto para a sua decomposição na atmosfera, na ausência de poluentes, é apresentado a seguir.
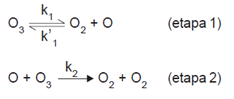
Alguns processos químicos ocorrem em várias etapas. As reações globais são as que ocorrem em mais de uma etapa. A velocidade desta reação depende da velocidade das etapas participantes. Quando isto acontecer, determina-se a velocidade da reação através da etapa lenta.
Considerando que a etapa lenta do processo é a 2, qual é a relação de dependência existente entre a velocidade de decomposição do ozônio e as concentrações das espécies envolvidas?
A velocidade é diretamente proporcional à concentração de O2.
A velocidade é inversamente proporcional à concentração de O3.
A velocidade é inversamente proporcional à concentração de O2.
A velocidade é diretamente proporcional à concentração de O3.
A velocidade não depende da concentração de O2.
A termodinâmica é uma ciência experimental, pois a partir da observação de alguns fenômenos físico-químicos foram elaboradas leis básicas, conhecidas como a Lei Zero, a Primeira, a Segunda e a Terceira Leis da Termodinâmica. Está ciência é a área da Química que se dedica ao estudo das transformações de energia e o entendimento da primeira lei da termodinâmica envolve a compreensão de algumas formas de energia, tais como o calor e trabalho.
A respeito da primeira lei da termodinâmica, avalie as afirmações a seguir.
- A energia interna permanece constante independente de qual seja o sistema de estudo.
- Em um processo de expansão livre em que não há trocas de calor com a vizinhança, a energia interna do sistema diminui.
- A variação de energia interna de um sistema fechado é igual à energia transferida como calor ou trabalho através de suas fronteiras.
- Para processos adiabáticos, a variação da energia interna está associada ao trabalho realizado pelo sistema ou sobre o sistema.
É correto apenas o que se afirma em:
I, II e IV
I e II
II e III
III e IV
I, III e IV
Reações com energia livre de Gibbs negativo liberam energia livre e são chamadas de reações exergônicas, o que significa que os reagentes, têm mais energia livre que os produtos. Já em reações com energia livre de Gibbs positivo, por sua vez, precisam de entrada de energia e são chamadas de reações endergônicas, o que significa que os produtos, têm mais energia livre que os reagentes
Os gráficos abaixo representam valores de Energia livre de Gibbs, de acordo com a extensão da reação, em três situações distintas.
 Com relação a esse tema, assinale a opção que descreve corretamente o comportamento representado em cada um dos gráficos acima.
Com relação a esse tema, assinale a opção que descreve corretamente o comportamento representado em cada um dos gráficos acima.
No gráfico I, a reação não é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico II, a reação é espontânea e os produtos são favorecidos em relação aos reagentes; no gráfico III, os produtos e os reagentes são favorecidos de forma aproximada.
No gráfico I, a reação é espontânea e os produtos são favorecidos em relação aos reagentes; no gráfico II, a reação não é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico III, os produtos e os reagentes são igualmente favorecidos.
No gráfico I, a reação é endotérmica e os produtos são favorecidos em relação aos reagentes; no gráfico II, a reação é exotérmica e os reagentes são favorecidos em relação aos produtos; no gráfico III, a reação não é espontânea e os produtos são favorecidos em relação aos reagentes.
No gráfico I, a reação não está em equilíbrio e os reagentes são favorecidos em relação aos produtos; no gráfico II, areação não é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico III, a reação é espontânea e os produtos e reagentes são igualmente favorecidos.
No gráfico I, a reação não é espontânea e os produtos são favorecidos em relação aos reagentes; no gráfico II, a reação é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico III, os produtos são favorecidos em relação aos reagentes.
O etanol é um combustível produzido a partir de fontes renováveis e, ao ser utilizado como aditivo da gasolina, reduz as emissões de gases de efeito estufa. Essas duas características lhe dão importância estratégica no combate à intensificação do efeito estufa e seus efeitos nas mudanças climáticas globais e colocam o produto em linha com os princípios do desenvolvimento sustentável. Para ser usado como tal, o processo de combustão do etanol deve ser exotérmico e pouco poluente. A reação da combustão desse combustível é dada pela reação não balanceada a seguir:
C2H6O + O2 → CO2 + H2O
ÚNICA. Produção e uso do etanol no Brasil. Disponível em: . Acesso em: 7 set. 2011.
A tabela a seguir traz informações sobre as energias, em termos de entalpia, das ligações envolvidas na reação química de combustão do etanol.

Com base nessas informações, analise as afirmações que se seguem.
I. A energia envolvida na quebra das ligações C–H é +2 155 kJ.
II. A energia envolvida na quebra das ligações O=O é +1 482 kJ.
III. A energia envolvida na formação das ligações C=O é -3 196 kJ.
IV. A energia envolvida na formação das ligações O–H é -918 kJ.
É correto apenas o que se afirma em:
II e IV
I e IV
II e III
III
I
Os coloides, ou também chamados sistemas coloidais, são sistemas que apresentam um ou mais componentes possuindo dimensões entre 1 nm a 1 µm. Podemos citar como exemplos de sistemas coloidais o mel, gelatina, maionese, sangue, etc., muitos deles sendo confundidos, erroneamente, com soluções.
Um exemplo claro desse erro de análise ocorre quando misturamos detergente à água, formando um sistema coloidal. Analisando mais profundamente a química dos coloides, podemos afirmar corretamente que:
as micelas são muito pequenas para serem vistas a olho nú e, por conta disso, não promovem o espalhamento da luz.
dispersões coloidais são mantidas estáveis, devido às atrações eletrostáticas que ocorrem entre a superfície das partículas coloidais.
uma maneira prática de diferenciar uma solução de uma dispersão coloidal é por meio do efeito Tyndall, observado somente em soluções.
em meio aquoso, a porção hidrofílica das moléculas de detergente orientam-se na parte interna das micelas.
as partículas de coloides podem ser formadas tanto por agregados de moléculas, como por macromoléculas dispersas.
Durante o acompanhamento da quantidade de matéria orgânica em um córrego, resultados de análises de amostras de 100 mL de água, recolhidas, ao longo de três meses, comprovaram a presença de, em média, 3,2 mg de matéria orgânica, na forma de glicose C6H12O6 (massa molar é 180 g/mol).
Com base nessas análises, 5 pareceres foram elaborados, por pessoas diferente:
P1: A qualidade da água tornou-se inadequada para sustentar a vida aquática e, nas atuais condições, apenas cerca de 25% da matéria orgânica pode ser decomposto.
P2: A qualidade da água do rio ainda é boa, uma vez que cerca de três quartos da matéria orgânica podem ser decompostos.
P3: Nas condições atuais, no máximo, 50% da matéria orgânica pode ser decomposto, e a manutenção da vida aquática fica comprometida.
P4: A qualidade da água do rio é boa. Há oxigênio na água suficiente para degradar toda a matéria orgânica e manter a vida aquática.
P5: A quantidade de matéria orgânica precisa ser reduzida a, aproximadamente, 2% dos níveis atuais para poder sustentar a vida aquática.
Ao analisar os relatórios, um químico levou em consideração os seguintes pontos:
a concentração mínima de O2 na água para sustentar a vida aquática é de 5 ppm, à temperatura média de 200 C;
a solubilidade do oxigênio em rios depende de vários fatores, mas para cálculos mais simples pode ser considerada igual a solubilidade do O2 em água, que é de 9 ppm, a 200 C e 1 atm.
Com base nesses ponto, o químico recomendou o relatório:
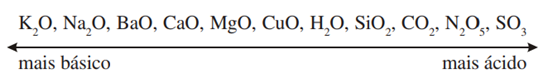

os carbonatos de metais alcalinos são mais estáveis que os de metais alcalino-terrosos.
a entalpia de formação dos carbonatos é negativa.
o carbonato de cálcio se decompõe espontaneamente acima de 400°C.
a formação dos carbonatos é favorecida pelo aumento de temperatura.
a entropia de formação dos carbonatos é positiva.
O ozônio tem grande importância nos processos que ocorrem na troposfera. Um mecanismo proposto para a sua decomposição na atmosfera, na ausência de poluentes, é apresentado a seguir.
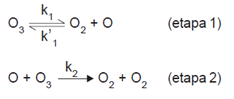
Alguns processos químicos ocorrem em várias etapas. As reações globais são as que ocorrem em mais de uma etapa. A velocidade desta reação depende da velocidade das etapas participantes. Quando isto acontecer, determina-se a velocidade da reação através da etapa lenta.
Considerando que a etapa lenta do processo é a 2, qual é a relação de dependência existente entre a velocidade de decomposição do ozônio e as concentrações das espécies envolvidas?
A velocidade é diretamente proporcional à concentração de O2.
A velocidade é inversamente proporcional à concentração de O3.
A velocidade é inversamente proporcional à concentração de O2.
A velocidade é diretamente proporcional à concentração de O3.
A velocidade não depende da concentração de O2.
A termodinâmica é uma ciência experimental, pois a partir da observação de alguns fenômenos físico-químicos foram elaboradas leis básicas, conhecidas como a Lei Zero, a Primeira, a Segunda e a Terceira Leis da Termodinâmica. Está ciência é a área da Química que se dedica ao estudo das transformações de energia e o entendimento da primeira lei da termodinâmica envolve a compreensão de algumas formas de energia, tais como o calor e trabalho.
A respeito da primeira lei da termodinâmica, avalie as afirmações a seguir.
- A energia interna permanece constante independente de qual seja o sistema de estudo.
- Em um processo de expansão livre em que não há trocas de calor com a vizinhança, a energia interna do sistema diminui.
- A variação de energia interna de um sistema fechado é igual à energia transferida como calor ou trabalho através de suas fronteiras.
- Para processos adiabáticos, a variação da energia interna está associada ao trabalho realizado pelo sistema ou sobre o sistema.
É correto apenas o que se afirma em:
I, II e IV
I e II
II e III
III e IV
I, III e IV
Reações com energia livre de Gibbs negativo liberam energia livre e são chamadas de reações exergônicas, o que significa que os reagentes, têm mais energia livre que os produtos. Já em reações com energia livre de Gibbs positivo, por sua vez, precisam de entrada de energia e são chamadas de reações endergônicas, o que significa que os produtos, têm mais energia livre que os reagentes
Os gráficos abaixo representam valores de Energia livre de Gibbs, de acordo com a extensão da reação, em três situações distintas.
 Com relação a esse tema, assinale a opção que descreve corretamente o comportamento representado em cada um dos gráficos acima.
Com relação a esse tema, assinale a opção que descreve corretamente o comportamento representado em cada um dos gráficos acima.
No gráfico I, a reação não é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico II, a reação é espontânea e os produtos são favorecidos em relação aos reagentes; no gráfico III, os produtos e os reagentes são favorecidos de forma aproximada.
No gráfico I, a reação é espontânea e os produtos são favorecidos em relação aos reagentes; no gráfico II, a reação não é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico III, os produtos e os reagentes são igualmente favorecidos.
No gráfico I, a reação é endotérmica e os produtos são favorecidos em relação aos reagentes; no gráfico II, a reação é exotérmica e os reagentes são favorecidos em relação aos produtos; no gráfico III, a reação não é espontânea e os produtos são favorecidos em relação aos reagentes.
No gráfico I, a reação não está em equilíbrio e os reagentes são favorecidos em relação aos produtos; no gráfico II, areação não é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico III, a reação é espontânea e os produtos e reagentes são igualmente favorecidos.
No gráfico I, a reação não é espontânea e os produtos são favorecidos em relação aos reagentes; no gráfico II, a reação é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico III, os produtos são favorecidos em relação aos reagentes.
O etanol é um combustível produzido a partir de fontes renováveis e, ao ser utilizado como aditivo da gasolina, reduz as emissões de gases de efeito estufa. Essas duas características lhe dão importância estratégica no combate à intensificação do efeito estufa e seus efeitos nas mudanças climáticas globais e colocam o produto em linha com os princípios do desenvolvimento sustentável. Para ser usado como tal, o processo de combustão do etanol deve ser exotérmico e pouco poluente. A reação da combustão desse combustível é dada pela reação não balanceada a seguir:
C2H6O + O2 → CO2 + H2O
ÚNICA. Produção e uso do etanol no Brasil. Disponível em: . Acesso em: 7 set. 2011.
A tabela a seguir traz informações sobre as energias, em termos de entalpia, das ligações envolvidas na reação química de combustão do etanol.

Com base nessas informações, analise as afirmações que se seguem.
I. A energia envolvida na quebra das ligações C–H é +2 155 kJ.
II. A energia envolvida na quebra das ligações O=O é +1 482 kJ.
III. A energia envolvida na formação das ligações C=O é -3 196 kJ.
IV. A energia envolvida na formação das ligações O–H é -918 kJ.
É correto apenas o que se afirma em:
II e IV
I e IV
II e III
III
I
Os coloides, ou também chamados sistemas coloidais, são sistemas que apresentam um ou mais componentes possuindo dimensões entre 1 nm a 1 µm. Podemos citar como exemplos de sistemas coloidais o mel, gelatina, maionese, sangue, etc., muitos deles sendo confundidos, erroneamente, com soluções.
Um exemplo claro desse erro de análise ocorre quando misturamos detergente à água, formando um sistema coloidal. Analisando mais profundamente a química dos coloides, podemos afirmar corretamente que:
as micelas são muito pequenas para serem vistas a olho nú e, por conta disso, não promovem o espalhamento da luz.
dispersões coloidais são mantidas estáveis, devido às atrações eletrostáticas que ocorrem entre a superfície das partículas coloidais.
uma maneira prática de diferenciar uma solução de uma dispersão coloidal é por meio do efeito Tyndall, observado somente em soluções.
em meio aquoso, a porção hidrofílica das moléculas de detergente orientam-se na parte interna das micelas.
as partículas de coloides podem ser formadas tanto por agregados de moléculas, como por macromoléculas dispersas.
Durante o acompanhamento da quantidade de matéria orgânica em um córrego, resultados de análises de amostras de 100 mL de água, recolhidas, ao longo de três meses, comprovaram a presença de, em média, 3,2 mg de matéria orgânica, na forma de glicose C6H12O6 (massa molar é 180 g/mol).
Com base nessas análises, 5 pareceres foram elaborados, por pessoas diferente:
P1: A qualidade da água tornou-se inadequada para sustentar a vida aquática e, nas atuais condições, apenas cerca de 25% da matéria orgânica pode ser decomposto.
P2: A qualidade da água do rio ainda é boa, uma vez que cerca de três quartos da matéria orgânica podem ser decompostos.
P3: Nas condições atuais, no máximo, 50% da matéria orgânica pode ser decomposto, e a manutenção da vida aquática fica comprometida.
P4: A qualidade da água do rio é boa. Há oxigênio na água suficiente para degradar toda a matéria orgânica e manter a vida aquática.
P5: A quantidade de matéria orgânica precisa ser reduzida a, aproximadamente, 2% dos níveis atuais para poder sustentar a vida aquática.
Ao analisar os relatórios, um químico levou em consideração os seguintes pontos:
a concentração mínima de O2 na água para sustentar a vida aquática é de 5 ppm, à temperatura média de 200 C;
a solubilidade do oxigênio em rios depende de vários fatores, mas para cálculos mais simples pode ser considerada igual a solubilidade do O2 em água, que é de 9 ppm, a 200 C e 1 atm.
Com base nesses ponto, o químico recomendou o relatório:
A velocidade é diretamente proporcional à concentração de O2.
A velocidade é inversamente proporcional à concentração de O3.
A velocidade é inversamente proporcional à concentração de O2.
A velocidade é diretamente proporcional à concentração de O3.
A velocidade não depende da concentração de O2.
A termodinâmica é uma ciência experimental, pois a partir da observação de alguns fenômenos físico-químicos foram elaboradas leis básicas, conhecidas como a Lei Zero, a Primeira, a Segunda e a Terceira Leis da Termodinâmica. Está ciência é a área da Química que se dedica ao estudo das transformações de energia e o entendimento da primeira lei da termodinâmica envolve a compreensão de algumas formas de energia, tais como o calor e trabalho.
A respeito da primeira lei da termodinâmica, avalie as afirmações a seguir.
- A energia interna permanece constante independente de qual seja o sistema de estudo.
- Em um processo de expansão livre em que não há trocas de calor com a vizinhança, a energia interna do sistema diminui.
- A variação de energia interna de um sistema fechado é igual à energia transferida como calor ou trabalho através de suas fronteiras.
- Para processos adiabáticos, a variação da energia interna está associada ao trabalho realizado pelo sistema ou sobre o sistema.
É correto apenas o que se afirma em:
I, II e IV
I e II
II e III
III e IV
I, III e IV
Reações com energia livre de Gibbs negativo liberam energia livre e são chamadas de reações exergônicas, o que significa que os reagentes, têm mais energia livre que os produtos. Já em reações com energia livre de Gibbs positivo, por sua vez, precisam de entrada de energia e são chamadas de reações endergônicas, o que significa que os produtos, têm mais energia livre que os reagentes
Os gráficos abaixo representam valores de Energia livre de Gibbs, de acordo com a extensão da reação, em três situações distintas.
 Com relação a esse tema, assinale a opção que descreve corretamente o comportamento representado em cada um dos gráficos acima.
Com relação a esse tema, assinale a opção que descreve corretamente o comportamento representado em cada um dos gráficos acima.
No gráfico I, a reação não é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico II, a reação é espontânea e os produtos são favorecidos em relação aos reagentes; no gráfico III, os produtos e os reagentes são favorecidos de forma aproximada.
No gráfico I, a reação é espontânea e os produtos são favorecidos em relação aos reagentes; no gráfico II, a reação não é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico III, os produtos e os reagentes são igualmente favorecidos.
No gráfico I, a reação é endotérmica e os produtos são favorecidos em relação aos reagentes; no gráfico II, a reação é exotérmica e os reagentes são favorecidos em relação aos produtos; no gráfico III, a reação não é espontânea e os produtos são favorecidos em relação aos reagentes.
No gráfico I, a reação não está em equilíbrio e os reagentes são favorecidos em relação aos produtos; no gráfico II, areação não é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico III, a reação é espontânea e os produtos e reagentes são igualmente favorecidos.
No gráfico I, a reação não é espontânea e os produtos são favorecidos em relação aos reagentes; no gráfico II, a reação é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico III, os produtos são favorecidos em relação aos reagentes.
O etanol é um combustível produzido a partir de fontes renováveis e, ao ser utilizado como aditivo da gasolina, reduz as emissões de gases de efeito estufa. Essas duas características lhe dão importância estratégica no combate à intensificação do efeito estufa e seus efeitos nas mudanças climáticas globais e colocam o produto em linha com os princípios do desenvolvimento sustentável. Para ser usado como tal, o processo de combustão do etanol deve ser exotérmico e pouco poluente. A reação da combustão desse combustível é dada pela reação não balanceada a seguir:
C2H6O + O2 → CO2 + H2O
ÚNICA. Produção e uso do etanol no Brasil. Disponível em: . Acesso em: 7 set. 2011.
A tabela a seguir traz informações sobre as energias, em termos de entalpia, das ligações envolvidas na reação química de combustão do etanol.

Com base nessas informações, analise as afirmações que se seguem.
I. A energia envolvida na quebra das ligações C–H é +2 155 kJ.
II. A energia envolvida na quebra das ligações O=O é +1 482 kJ.
III. A energia envolvida na formação das ligações C=O é -3 196 kJ.
IV. A energia envolvida na formação das ligações O–H é -918 kJ.
É correto apenas o que se afirma em:
II e IV
I e IV
II e III
III
I
Os coloides, ou também chamados sistemas coloidais, são sistemas que apresentam um ou mais componentes possuindo dimensões entre 1 nm a 1 µm. Podemos citar como exemplos de sistemas coloidais o mel, gelatina, maionese, sangue, etc., muitos deles sendo confundidos, erroneamente, com soluções.
Um exemplo claro desse erro de análise ocorre quando misturamos detergente à água, formando um sistema coloidal. Analisando mais profundamente a química dos coloides, podemos afirmar corretamente que:
as micelas são muito pequenas para serem vistas a olho nú e, por conta disso, não promovem o espalhamento da luz.
dispersões coloidais são mantidas estáveis, devido às atrações eletrostáticas que ocorrem entre a superfície das partículas coloidais.
uma maneira prática de diferenciar uma solução de uma dispersão coloidal é por meio do efeito Tyndall, observado somente em soluções.
em meio aquoso, a porção hidrofílica das moléculas de detergente orientam-se na parte interna das micelas.
as partículas de coloides podem ser formadas tanto por agregados de moléculas, como por macromoléculas dispersas.
Durante o acompanhamento da quantidade de matéria orgânica em um córrego, resultados de análises de amostras de 100 mL de água, recolhidas, ao longo de três meses, comprovaram a presença de, em média, 3,2 mg de matéria orgânica, na forma de glicose C6H12O6 (massa molar é 180 g/mol).
Com base nessas análises, 5 pareceres foram elaborados, por pessoas diferente:
P1: A qualidade da água tornou-se inadequada para sustentar a vida aquática e, nas atuais condições, apenas cerca de 25% da matéria orgânica pode ser decomposto.
P2: A qualidade da água do rio ainda é boa, uma vez que cerca de três quartos da matéria orgânica podem ser decompostos.
P3: Nas condições atuais, no máximo, 50% da matéria orgânica pode ser decomposto, e a manutenção da vida aquática fica comprometida.
P4: A qualidade da água do rio é boa. Há oxigênio na água suficiente para degradar toda a matéria orgânica e manter a vida aquática.
P5: A quantidade de matéria orgânica precisa ser reduzida a, aproximadamente, 2% dos níveis atuais para poder sustentar a vida aquática.
Ao analisar os relatórios, um químico levou em consideração os seguintes pontos:
a concentração mínima de O2 na água para sustentar a vida aquática é de 5 ppm, à temperatura média de 200 C;
a solubilidade do oxigênio em rios depende de vários fatores, mas para cálculos mais simples pode ser considerada igual a solubilidade do O2 em água, que é de 9 ppm, a 200 C e 1 atm.
Com base nesses ponto, o químico recomendou o relatório:
I, II e IV
I e II
II e III
III e IV
I, III e IV
Reações com energia livre de Gibbs negativo liberam energia livre e são chamadas de reações exergônicas, o que significa que os reagentes, têm mais energia livre que os produtos. Já em reações com energia livre de Gibbs positivo, por sua vez, precisam de entrada de energia e são chamadas de reações endergônicas, o que significa que os produtos, têm mais energia livre que os reagentes
Os gráficos abaixo representam valores de Energia livre de Gibbs, de acordo com a extensão da reação, em três situações distintas.
 Com relação a esse tema, assinale a opção que descreve corretamente o comportamento representado em cada um dos gráficos acima.
Com relação a esse tema, assinale a opção que descreve corretamente o comportamento representado em cada um dos gráficos acima.
No gráfico I, a reação não é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico II, a reação é espontânea e os produtos são favorecidos em relação aos reagentes; no gráfico III, os produtos e os reagentes são favorecidos de forma aproximada.
No gráfico I, a reação é espontânea e os produtos são favorecidos em relação aos reagentes; no gráfico II, a reação não é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico III, os produtos e os reagentes são igualmente favorecidos.
No gráfico I, a reação é endotérmica e os produtos são favorecidos em relação aos reagentes; no gráfico II, a reação é exotérmica e os reagentes são favorecidos em relação aos produtos; no gráfico III, a reação não é espontânea e os produtos são favorecidos em relação aos reagentes.
No gráfico I, a reação não está em equilíbrio e os reagentes são favorecidos em relação aos produtos; no gráfico II, areação não é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico III, a reação é espontânea e os produtos e reagentes são igualmente favorecidos.
No gráfico I, a reação não é espontânea e os produtos são favorecidos em relação aos reagentes; no gráfico II, a reação é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico III, os produtos são favorecidos em relação aos reagentes.
O etanol é um combustível produzido a partir de fontes renováveis e, ao ser utilizado como aditivo da gasolina, reduz as emissões de gases de efeito estufa. Essas duas características lhe dão importância estratégica no combate à intensificação do efeito estufa e seus efeitos nas mudanças climáticas globais e colocam o produto em linha com os princípios do desenvolvimento sustentável. Para ser usado como tal, o processo de combustão do etanol deve ser exotérmico e pouco poluente. A reação da combustão desse combustível é dada pela reação não balanceada a seguir:
C2H6O + O2 → CO2 + H2O
ÚNICA. Produção e uso do etanol no Brasil. Disponível em: . Acesso em: 7 set. 2011.
A tabela a seguir traz informações sobre as energias, em termos de entalpia, das ligações envolvidas na reação química de combustão do etanol.

Com base nessas informações, analise as afirmações que se seguem.
I. A energia envolvida na quebra das ligações C–H é +2 155 kJ.
II. A energia envolvida na quebra das ligações O=O é +1 482 kJ.
III. A energia envolvida na formação das ligações C=O é -3 196 kJ.
IV. A energia envolvida na formação das ligações O–H é -918 kJ.
É correto apenas o que se afirma em:
II e IV
I e IV
II e III
III
I
Os coloides, ou também chamados sistemas coloidais, são sistemas que apresentam um ou mais componentes possuindo dimensões entre 1 nm a 1 µm. Podemos citar como exemplos de sistemas coloidais o mel, gelatina, maionese, sangue, etc., muitos deles sendo confundidos, erroneamente, com soluções.
Um exemplo claro desse erro de análise ocorre quando misturamos detergente à água, formando um sistema coloidal. Analisando mais profundamente a química dos coloides, podemos afirmar corretamente que:
as micelas são muito pequenas para serem vistas a olho nú e, por conta disso, não promovem o espalhamento da luz.
dispersões coloidais são mantidas estáveis, devido às atrações eletrostáticas que ocorrem entre a superfície das partículas coloidais.
uma maneira prática de diferenciar uma solução de uma dispersão coloidal é por meio do efeito Tyndall, observado somente em soluções.
em meio aquoso, a porção hidrofílica das moléculas de detergente orientam-se na parte interna das micelas.
as partículas de coloides podem ser formadas tanto por agregados de moléculas, como por macromoléculas dispersas.
Durante o acompanhamento da quantidade de matéria orgânica em um córrego, resultados de análises de amostras de 100 mL de água, recolhidas, ao longo de três meses, comprovaram a presença de, em média, 3,2 mg de matéria orgânica, na forma de glicose C6H12O6 (massa molar é 180 g/mol).
Com base nessas análises, 5 pareceres foram elaborados, por pessoas diferente:
P1: A qualidade da água tornou-se inadequada para sustentar a vida aquática e, nas atuais condições, apenas cerca de 25% da matéria orgânica pode ser decomposto.
P2: A qualidade da água do rio ainda é boa, uma vez que cerca de três quartos da matéria orgânica podem ser decompostos.
P3: Nas condições atuais, no máximo, 50% da matéria orgânica pode ser decomposto, e a manutenção da vida aquática fica comprometida.
P4: A qualidade da água do rio é boa. Há oxigênio na água suficiente para degradar toda a matéria orgânica e manter a vida aquática.
P5: A quantidade de matéria orgânica precisa ser reduzida a, aproximadamente, 2% dos níveis atuais para poder sustentar a vida aquática.
Ao analisar os relatórios, um químico levou em consideração os seguintes pontos:
a concentração mínima de O2 na água para sustentar a vida aquática é de 5 ppm, à temperatura média de 200 C;
a solubilidade do oxigênio em rios depende de vários fatores, mas para cálculos mais simples pode ser considerada igual a solubilidade do O2 em água, que é de 9 ppm, a 200 C e 1 atm.
Com base nesses ponto, o químico recomendou o relatório:
No gráfico I, a reação não é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico II, a reação é espontânea e os produtos são favorecidos em relação aos reagentes; no gráfico III, os produtos e os reagentes são favorecidos de forma aproximada.
No gráfico I, a reação é espontânea e os produtos são favorecidos em relação aos reagentes; no gráfico II, a reação não é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico III, os produtos e os reagentes são igualmente favorecidos.
No gráfico I, a reação é endotérmica e os produtos são favorecidos em relação aos reagentes; no gráfico II, a reação é exotérmica e os reagentes são favorecidos em relação aos produtos; no gráfico III, a reação não é espontânea e os produtos são favorecidos em relação aos reagentes.
No gráfico I, a reação não está em equilíbrio e os reagentes são favorecidos em relação aos produtos; no gráfico II, areação não é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico III, a reação é espontânea e os produtos e reagentes são igualmente favorecidos.
No gráfico I, a reação não é espontânea e os produtos são favorecidos em relação aos reagentes; no gráfico II, a reação é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico III, os produtos são favorecidos em relação aos reagentes.
O etanol é um combustível produzido a partir de fontes renováveis e, ao ser utilizado como aditivo da gasolina, reduz as emissões de gases de efeito estufa. Essas duas características lhe dão importância estratégica no combate à intensificação do efeito estufa e seus efeitos nas mudanças climáticas globais e colocam o produto em linha com os princípios do desenvolvimento sustentável. Para ser usado como tal, o processo de combustão do etanol deve ser exotérmico e pouco poluente. A reação da combustão desse combustível é dada pela reação não balanceada a seguir:
C2H6O + O2 → CO2 + H2O
ÚNICA. Produção e uso do etanol no Brasil. Disponível em: . Acesso em: 7 set. 2011.
A tabela a seguir traz informações sobre as energias, em termos de entalpia, das ligações envolvidas na reação química de combustão do etanol.

Com base nessas informações, analise as afirmações que se seguem.
I. A energia envolvida na quebra das ligações C–H é +2 155 kJ.
II. A energia envolvida na quebra das ligações O=O é +1 482 kJ.
III. A energia envolvida na formação das ligações C=O é -3 196 kJ.
IV. A energia envolvida na formação das ligações O–H é -918 kJ.
É correto apenas o que se afirma em:
II e IV
I e IV
II e III
III
I
Os coloides, ou também chamados sistemas coloidais, são sistemas que apresentam um ou mais componentes possuindo dimensões entre 1 nm a 1 µm. Podemos citar como exemplos de sistemas coloidais o mel, gelatina, maionese, sangue, etc., muitos deles sendo confundidos, erroneamente, com soluções.
Um exemplo claro desse erro de análise ocorre quando misturamos detergente à água, formando um sistema coloidal. Analisando mais profundamente a química dos coloides, podemos afirmar corretamente que:
as micelas são muito pequenas para serem vistas a olho nú e, por conta disso, não promovem o espalhamento da luz.
dispersões coloidais são mantidas estáveis, devido às atrações eletrostáticas que ocorrem entre a superfície das partículas coloidais.
uma maneira prática de diferenciar uma solução de uma dispersão coloidal é por meio do efeito Tyndall, observado somente em soluções.
em meio aquoso, a porção hidrofílica das moléculas de detergente orientam-se na parte interna das micelas.
as partículas de coloides podem ser formadas tanto por agregados de moléculas, como por macromoléculas dispersas.
Durante o acompanhamento da quantidade de matéria orgânica em um córrego, resultados de análises de amostras de 100 mL de água, recolhidas, ao longo de três meses, comprovaram a presença de, em média, 3,2 mg de matéria orgânica, na forma de glicose C6H12O6 (massa molar é 180 g/mol).
Com base nessas análises, 5 pareceres foram elaborados, por pessoas diferente:
P1: A qualidade da água tornou-se inadequada para sustentar a vida aquática e, nas atuais condições, apenas cerca de 25% da matéria orgânica pode ser decomposto.
P2: A qualidade da água do rio ainda é boa, uma vez que cerca de três quartos da matéria orgânica podem ser decompostos.
P3: Nas condições atuais, no máximo, 50% da matéria orgânica pode ser decomposto, e a manutenção da vida aquática fica comprometida.
P4: A qualidade da água do rio é boa. Há oxigênio na água suficiente para degradar toda a matéria orgânica e manter a vida aquática.
P5: A quantidade de matéria orgânica precisa ser reduzida a, aproximadamente, 2% dos níveis atuais para poder sustentar a vida aquática.
Ao analisar os relatórios, um químico levou em consideração os seguintes pontos:
a concentração mínima de O2 na água para sustentar a vida aquática é de 5 ppm, à temperatura média de 200 C;
a solubilidade do oxigênio em rios depende de vários fatores, mas para cálculos mais simples pode ser considerada igual a solubilidade do O2 em água, que é de 9 ppm, a 200 C e 1 atm.
Com base nesses ponto, o químico recomendou o relatório:

II e IV
I e IV
II e III
III
I
Os coloides, ou também chamados sistemas coloidais, são sistemas que apresentam um ou mais componentes possuindo dimensões entre 1 nm a 1 µm. Podemos citar como exemplos de sistemas coloidais o mel, gelatina, maionese, sangue, etc., muitos deles sendo confundidos, erroneamente, com soluções.
Um exemplo claro desse erro de análise ocorre quando misturamos detergente à água, formando um sistema coloidal. Analisando mais profundamente a química dos coloides, podemos afirmar corretamente que:
as micelas são muito pequenas para serem vistas a olho nú e, por conta disso, não promovem o espalhamento da luz.
dispersões coloidais são mantidas estáveis, devido às atrações eletrostáticas que ocorrem entre a superfície das partículas coloidais.
uma maneira prática de diferenciar uma solução de uma dispersão coloidal é por meio do efeito Tyndall, observado somente em soluções.
em meio aquoso, a porção hidrofílica das moléculas de detergente orientam-se na parte interna das micelas.
as partículas de coloides podem ser formadas tanto por agregados de moléculas, como por macromoléculas dispersas.
Durante o acompanhamento da quantidade de matéria orgânica em um córrego, resultados de análises de amostras de 100 mL de água, recolhidas, ao longo de três meses, comprovaram a presença de, em média, 3,2 mg de matéria orgânica, na forma de glicose C6H12O6 (massa molar é 180 g/mol).
Com base nessas análises, 5 pareceres foram elaborados, por pessoas diferente:
P1: A qualidade da água tornou-se inadequada para sustentar a vida aquática e, nas atuais condições, apenas cerca de 25% da matéria orgânica pode ser decomposto.
P2: A qualidade da água do rio ainda é boa, uma vez que cerca de três quartos da matéria orgânica podem ser decompostos.
P3: Nas condições atuais, no máximo, 50% da matéria orgânica pode ser decomposto, e a manutenção da vida aquática fica comprometida.
P4: A qualidade da água do rio é boa. Há oxigênio na água suficiente para degradar toda a matéria orgânica e manter a vida aquática.
P5: A quantidade de matéria orgânica precisa ser reduzida a, aproximadamente, 2% dos níveis atuais para poder sustentar a vida aquática.
Ao analisar os relatórios, um químico levou em consideração os seguintes pontos:
a concentração mínima de O2 na água para sustentar a vida aquática é de 5 ppm, à temperatura média de 200 C;
a solubilidade do oxigênio em rios depende de vários fatores, mas para cálculos mais simples pode ser considerada igual a solubilidade do O2 em água, que é de 9 ppm, a 200 C e 1 atm.
Com base nesses ponto, o químico recomendou o relatório:
as micelas são muito pequenas para serem vistas a olho nú e, por conta disso, não promovem o espalhamento da luz.
dispersões coloidais são mantidas estáveis, devido às atrações eletrostáticas que ocorrem entre a superfície das partículas coloidais.
uma maneira prática de diferenciar uma solução de uma dispersão coloidal é por meio do efeito Tyndall, observado somente em soluções.
em meio aquoso, a porção hidrofílica das moléculas de detergente orientam-se na parte interna das micelas.
as partículas de coloides podem ser formadas tanto por agregados de moléculas, como por macromoléculas dispersas.