PRÁTICA DE FÍSICO-QUÍMICA EXPERIMENTAL II
Analisando o deslocamento de equilíbrio de acordo com a temperatura, podemos dizer que se a temperatura aumenta e a reação endotérmica absorve energia, a reação tem tendência a se deslocar em direção ao lado que consuma esta energia adicionada. Caso contrário, se a temperatura diminui, a tendência da reação é se deslocar para o lado em que a energia é liberada.
Sendo assim a equação abaixo representa o equilíbrio químico obtido pela mistura de uma solução de cloreto de cobalto II com outra solução de ácido clorídrico:
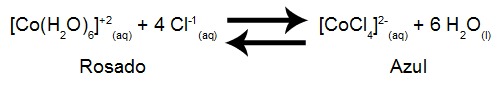
Se a mistura das soluções de cloreto de cobalto II e ácido clorídrico após seu aquecimento apresentou uma coloração azul, significa que: