ESTUDOS INTERDISCIPLINARES EM QUÍMICA
Os carbonatos resultam da combinação do CO32- com metais e metalóides, ou da reação do ácido carbônico com esses elementos. Os carbonatos de metais alcalinos e alcalino-terrosos podem ser obtidos a partir de seus óxidos, conforme a equação abaixo:
MxO(s) + CO2(g) → MxCO3(s), para M = Na, K, Ca e Mg
A variação de energia livre dessas reações permite estabelecer uma escala de basicidade dos óxidos, conforme proposto por Flood e Förland. Os óxidos de metais alcalinos são em geral bases mais fortes do que os de alcalino-terrosos e, em cada grupo, a basicidade do óxido aumenta com o tamanho do metal. Isto se justifica porque a interação do cátion M+ com o íon O2- é mais fraca do que no caso de um cátion M2+ e também é mais fraca para cátions maiores, resultando um óxido com maior facilidade de ceder o íon O2-para um óxido ácido. A ordem de caráter ácido-básico de alguns óxidos é mostrada abaixo:
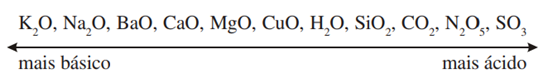
Sendo assim, quanto mais afastados estiverem dois óxidos nessa série, mais estável será o composto formado quando os óxidos reagirem entre si.
O diagrama a seguir apresenta os valores da energia de Gibbs padrão (ΔG°) para a formação de alguns destes carbonatos, em função da temperatura.
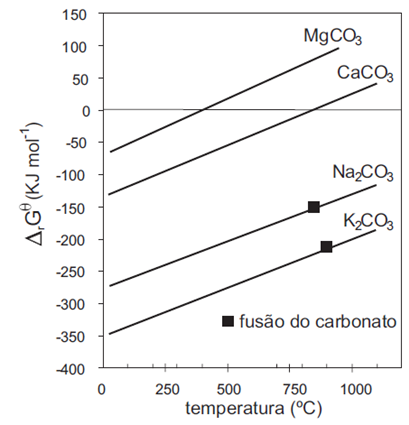
(MAIA & OSÓRIO. Quim. Nova, 26(4), 2003)
Com base neste diagrama, é correto afirmar que: