QUÍMICA TECNOLÓGICA
O ácido fosfórico, usado em refrigerantes do tipo cola e possível causador da osteoporose, pode ser formado a partir da equação não-balanceada:
Ca3(PO4)2 + H2SO4 ----> H3PO4 + CaSO4
Partindo-se de 62 g de Ca3(PO4)2 e usando-se quantidade suficiente de H2SO4, qual, em gramas, a massa aproximada de H3PO4 obtida?
45g
51g
19g
39 g
25g
A gasolina comercial é composta de uma mistura de hidrocarbonetos, que quando queimados produzem uma grande quantidade de energia. A queima (combustão) do isooctano (C8H18), um dos componentes da gasolina, pode ser representada pela equação química não balanceada:
C8H18 + O2 ----> CO2 + H2O
Os coeficientes da reação balanceada são:
1 : 25 : 4 : 16
2 : 50 : 8 : 32
4 : 25 : 16 : 18
4 : 50 : 8 : 32
2 : 25 : 16 : 18
Um maquinário apresenta uma peça de magnésio ligada a uma peça de ferro , de forma que: Mg0 / Mg2+ // Fe2+ / Fe0 é correto afirmar que:
o Fe0 é o catodo.
a solução de Fe2+ se concentrará.
a solução de Mg2+ se diluirá.
o Fe2+ se oxida.
o Mg0 é o oxidante.
A combustão completa do metano (CH4) produz dióxido de carbono (CO2) e água. A alternativa que representa o número de mols de CO2 produzido na combustão de 0,6 mol de CH4 é:
CH4(g) + O2(g) → CO2(g) + H2O(v)
0,3 mol.
1,5 mol.
0,9 mol.
0,6 mol.
1,2 mols.
Um conjunto é formado por um eletrodo de chumbo (Pb) imerso em 1,0 L de solução de PbSO4(aq) à 0,075 mol L-1, interligado a um eletrodo de cobre (Cu), em 1,0 L de solução de CuSO4(aq) à 0,01 mol L-1. Determine a energia gerada por esse conjunto, sabendo que os metais envolvidos apresentam os seguintes dados:
Cu2+(aq) + 2 e- --> Cu(s) E°red = +0,337 V
Pb2+ (aq) + 2 e- --> Pb(s) E°red = -0,133 V
Equação de Nernst:

ΔE = 0,496 V
ΔE = 1,500 V
ΔE = 0,230 V
ΔE = 0,444 V
ΔE = - 0,552 V
Sabendo-se que K é igual a 69 para a reação N2(g) + 3 H2(g) <===> 2 NH3(g) a 500 °C e que a análise de um recipiente de 7 L mostrou que a 500 °C se encontravam presentes, no estado de equilíbrio, 3,71 mols de hidrogênio e 4,55 mols de amoníaco, então o número de mols de nitrogênio presente no recipiente é:
0,288
0,414
0,510
0,653
0,144
O óxido de bário é usado na produção de certos tipos de vidros e na formação do meta arseniato de bário, de acordo com a equação seguir:
BaO + As2O5 ----> Ba3(AsO4)2
Após balancear, marque a alternativa que equivale à soma dos coeficientes estequiométricos:
10
12
4
5
6
Muitas misturas são feitas com vários compostos, formados por ligações diferentes. Em uma mistura que estão presentes água (H2O), sal comum (NaCl) e cloreto de cálcio (CaCl2) é um desses casos. Qual das alternativas contém o tipo correto de ligação que cada composto faz, respectivamente.
Iônica, covalente e covalente.
Covalente, covalente e iônica.
Covalente, iônica e covalente.
Iônica, iônica e iônica.
Covalente, iônica e iônica.
As ligações químicas tem a função principal de estabilizar os átomos envolvidos. Pode-se ter uma noção sobre essa estabilização através da "Teoria do Octeto". Dessa forma, uma molécula deve se formar para que os átomos envolvidos atinjam 8 elétrons na Camada de Valência, menos o hidrogênio que se estabiliza com 2 elétrons. Observe a molécula abaixo e determine qual deve ser o elemento X, para que o composto esteja corretamente representado:
Dados: P (Z = 15), S (Z = 16), C (Z = 6), N (Z = 7) e H (Z = 1).
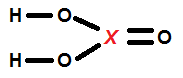
Carbono.
Hidrogênio
Nitrogênio.
Enxofre.
Fósforo.
A água oxigenada comercial é uma solução de peróxido de hidrogênio (H2O2), fortemente anti-séptica, por liberar O2. O peróxido de hidrogênio é muito utilizado em reações químicas como agente oxidante, ou seja, provoca a oxidação de outros compostos. Os percentuais, em massa, de hidrogênio e oxigênio, nesse composto, são, respectivamente:
45g
51g
19g
39 g
25g
A gasolina comercial é composta de uma mistura de hidrocarbonetos, que quando queimados produzem uma grande quantidade de energia. A queima (combustão) do isooctano (C8H18), um dos componentes da gasolina, pode ser representada pela equação química não balanceada:
C8H18 + O2 ----> CO2 + H2O
Os coeficientes da reação balanceada são:
1 : 25 : 4 : 16
2 : 50 : 8 : 32
4 : 25 : 16 : 18
4 : 50 : 8 : 32
2 : 25 : 16 : 18
Um maquinário apresenta uma peça de magnésio ligada a uma peça de ferro , de forma que: Mg0 / Mg2+ // Fe2+ / Fe0 é correto afirmar que:
o Fe0 é o catodo.
a solução de Fe2+ se concentrará.
a solução de Mg2+ se diluirá.
o Fe2+ se oxida.
o Mg0 é o oxidante.
A combustão completa do metano (CH4) produz dióxido de carbono (CO2) e água. A alternativa que representa o número de mols de CO2 produzido na combustão de 0,6 mol de CH4 é:
CH4(g) + O2(g) → CO2(g) + H2O(v)
0,3 mol.
1,5 mol.
0,9 mol.
0,6 mol.
1,2 mols.
Um conjunto é formado por um eletrodo de chumbo (Pb) imerso em 1,0 L de solução de PbSO4(aq) à 0,075 mol L-1, interligado a um eletrodo de cobre (Cu), em 1,0 L de solução de CuSO4(aq) à 0,01 mol L-1. Determine a energia gerada por esse conjunto, sabendo que os metais envolvidos apresentam os seguintes dados:
Cu2+(aq) + 2 e- --> Cu(s) E°red = +0,337 V
Pb2+ (aq) + 2 e- --> Pb(s) E°red = -0,133 V
Equação de Nernst:

ΔE = 0,496 V
ΔE = 1,500 V
ΔE = 0,230 V
ΔE = 0,444 V
ΔE = - 0,552 V
Sabendo-se que K é igual a 69 para a reação N2(g) + 3 H2(g) <===> 2 NH3(g) a 500 °C e que a análise de um recipiente de 7 L mostrou que a 500 °C se encontravam presentes, no estado de equilíbrio, 3,71 mols de hidrogênio e 4,55 mols de amoníaco, então o número de mols de nitrogênio presente no recipiente é:
0,288
0,414
0,510
0,653
0,144
O óxido de bário é usado na produção de certos tipos de vidros e na formação do meta arseniato de bário, de acordo com a equação seguir:
BaO + As2O5 ----> Ba3(AsO4)2
Após balancear, marque a alternativa que equivale à soma dos coeficientes estequiométricos:
10
12
4
5
6
Muitas misturas são feitas com vários compostos, formados por ligações diferentes. Em uma mistura que estão presentes água (H2O), sal comum (NaCl) e cloreto de cálcio (CaCl2) é um desses casos. Qual das alternativas contém o tipo correto de ligação que cada composto faz, respectivamente.
Iônica, covalente e covalente.
Covalente, covalente e iônica.
Covalente, iônica e covalente.
Iônica, iônica e iônica.
Covalente, iônica e iônica.
As ligações químicas tem a função principal de estabilizar os átomos envolvidos. Pode-se ter uma noção sobre essa estabilização através da "Teoria do Octeto". Dessa forma, uma molécula deve se formar para que os átomos envolvidos atinjam 8 elétrons na Camada de Valência, menos o hidrogênio que se estabiliza com 2 elétrons. Observe a molécula abaixo e determine qual deve ser o elemento X, para que o composto esteja corretamente representado:
Dados: P (Z = 15), S (Z = 16), C (Z = 6), N (Z = 7) e H (Z = 1).

Carbono.
Hidrogênio
Nitrogênio.
Enxofre.
Fósforo.
A água oxigenada comercial é uma solução de peróxido de hidrogênio (H2O2), fortemente anti-séptica, por liberar O2. O peróxido de hidrogênio é muito utilizado em reações químicas como agente oxidante, ou seja, provoca a oxidação de outros compostos. Os percentuais, em massa, de hidrogênio e oxigênio, nesse composto, são, respectivamente:
1 : 25 : 4 : 16
2 : 50 : 8 : 32
4 : 25 : 16 : 18
4 : 50 : 8 : 32
2 : 25 : 16 : 18
Um maquinário apresenta uma peça de magnésio ligada a uma peça de ferro , de forma que: Mg0 / Mg2+ // Fe2+ / Fe0 é correto afirmar que:
o Fe0 é o catodo.
a solução de Fe2+ se concentrará.
a solução de Mg2+ se diluirá.
o Fe2+ se oxida.
o Mg0 é o oxidante.
A combustão completa do metano (CH4) produz dióxido de carbono (CO2) e água. A alternativa que representa o número de mols de CO2 produzido na combustão de 0,6 mol de CH4 é:
CH4(g) + O2(g) → CO2(g) + H2O(v)
0,3 mol.
1,5 mol.
0,9 mol.
0,6 mol.
1,2 mols.
Um conjunto é formado por um eletrodo de chumbo (Pb) imerso em 1,0 L de solução de PbSO4(aq) à 0,075 mol L-1, interligado a um eletrodo de cobre (Cu), em 1,0 L de solução de CuSO4(aq) à 0,01 mol L-1. Determine a energia gerada por esse conjunto, sabendo que os metais envolvidos apresentam os seguintes dados:
Cu2+(aq) + 2 e- --> Cu(s) E°red = +0,337 V
Pb2+ (aq) + 2 e- --> Pb(s) E°red = -0,133 V
Equação de Nernst:

ΔE = 0,496 V
ΔE = 1,500 V
ΔE = 0,230 V
ΔE = 0,444 V
ΔE = - 0,552 V
Sabendo-se que K é igual a 69 para a reação N2(g) + 3 H2(g) <===> 2 NH3(g) a 500 °C e que a análise de um recipiente de 7 L mostrou que a 500 °C se encontravam presentes, no estado de equilíbrio, 3,71 mols de hidrogênio e 4,55 mols de amoníaco, então o número de mols de nitrogênio presente no recipiente é:
0,288
0,414
0,510
0,653
0,144
O óxido de bário é usado na produção de certos tipos de vidros e na formação do meta arseniato de bário, de acordo com a equação seguir:
BaO + As2O5 ----> Ba3(AsO4)2
Após balancear, marque a alternativa que equivale à soma dos coeficientes estequiométricos:
10
12
4
5
6
Muitas misturas são feitas com vários compostos, formados por ligações diferentes. Em uma mistura que estão presentes água (H2O), sal comum (NaCl) e cloreto de cálcio (CaCl2) é um desses casos. Qual das alternativas contém o tipo correto de ligação que cada composto faz, respectivamente.
Iônica, covalente e covalente.
Covalente, covalente e iônica.
Covalente, iônica e covalente.
Iônica, iônica e iônica.
Covalente, iônica e iônica.
As ligações químicas tem a função principal de estabilizar os átomos envolvidos. Pode-se ter uma noção sobre essa estabilização através da "Teoria do Octeto". Dessa forma, uma molécula deve se formar para que os átomos envolvidos atinjam 8 elétrons na Camada de Valência, menos o hidrogênio que se estabiliza com 2 elétrons. Observe a molécula abaixo e determine qual deve ser o elemento X, para que o composto esteja corretamente representado:
Dados: P (Z = 15), S (Z = 16), C (Z = 6), N (Z = 7) e H (Z = 1).

Carbono.
Hidrogênio
Nitrogênio.
Enxofre.
Fósforo.
A água oxigenada comercial é uma solução de peróxido de hidrogênio (H2O2), fortemente anti-séptica, por liberar O2. O peróxido de hidrogênio é muito utilizado em reações químicas como agente oxidante, ou seja, provoca a oxidação de outros compostos. Os percentuais, em massa, de hidrogênio e oxigênio, nesse composto, são, respectivamente:
o Fe0 é o catodo.
a solução de Fe2+ se concentrará.
a solução de Mg2+ se diluirá.
o Fe2+ se oxida.
o Mg0 é o oxidante.
A combustão completa do metano (CH4) produz dióxido de carbono (CO2) e água. A alternativa que representa o número de mols de CO2 produzido na combustão de 0,6 mol de CH4 é:
CH4(g) + O2(g) → CO2(g) + H2O(v)
0,3 mol.
1,5 mol.
0,9 mol.
0,6 mol.
1,2 mols.
Um conjunto é formado por um eletrodo de chumbo (Pb) imerso em 1,0 L de solução de PbSO4(aq) à 0,075 mol L-1, interligado a um eletrodo de cobre (Cu), em 1,0 L de solução de CuSO4(aq) à 0,01 mol L-1. Determine a energia gerada por esse conjunto, sabendo que os metais envolvidos apresentam os seguintes dados:
Cu2+(aq) + 2 e- --> Cu(s) E°red = +0,337 V
Pb2+ (aq) + 2 e- --> Pb(s) E°red = -0,133 V
Equação de Nernst:

ΔE = 0,496 V
ΔE = 1,500 V
ΔE = 0,230 V
ΔE = 0,444 V
ΔE = - 0,552 V
Sabendo-se que K é igual a 69 para a reação N2(g) + 3 H2(g) <===> 2 NH3(g) a 500 °C e que a análise de um recipiente de 7 L mostrou que a 500 °C se encontravam presentes, no estado de equilíbrio, 3,71 mols de hidrogênio e 4,55 mols de amoníaco, então o número de mols de nitrogênio presente no recipiente é:
0,288
0,414
0,510
0,653
0,144
O óxido de bário é usado na produção de certos tipos de vidros e na formação do meta arseniato de bário, de acordo com a equação seguir:
BaO + As2O5 ----> Ba3(AsO4)2
Após balancear, marque a alternativa que equivale à soma dos coeficientes estequiométricos:
10
12
4
5
6
Muitas misturas são feitas com vários compostos, formados por ligações diferentes. Em uma mistura que estão presentes água (H2O), sal comum (NaCl) e cloreto de cálcio (CaCl2) é um desses casos. Qual das alternativas contém o tipo correto de ligação que cada composto faz, respectivamente.
Iônica, covalente e covalente.
Covalente, covalente e iônica.
Covalente, iônica e covalente.
Iônica, iônica e iônica.
Covalente, iônica e iônica.
As ligações químicas tem a função principal de estabilizar os átomos envolvidos. Pode-se ter uma noção sobre essa estabilização através da "Teoria do Octeto". Dessa forma, uma molécula deve se formar para que os átomos envolvidos atinjam 8 elétrons na Camada de Valência, menos o hidrogênio que se estabiliza com 2 elétrons. Observe a molécula abaixo e determine qual deve ser o elemento X, para que o composto esteja corretamente representado:
Dados: P (Z = 15), S (Z = 16), C (Z = 6), N (Z = 7) e H (Z = 1).

Carbono.
Hidrogênio
Nitrogênio.
Enxofre.
Fósforo.
A água oxigenada comercial é uma solução de peróxido de hidrogênio (H2O2), fortemente anti-séptica, por liberar O2. O peróxido de hidrogênio é muito utilizado em reações químicas como agente oxidante, ou seja, provoca a oxidação de outros compostos. Os percentuais, em massa, de hidrogênio e oxigênio, nesse composto, são, respectivamente:
0,3 mol.
1,5 mol.
0,9 mol.
0,6 mol.
1,2 mols.
Um conjunto é formado por um eletrodo de chumbo (Pb) imerso em 1,0 L de solução de PbSO4(aq) à 0,075 mol L-1, interligado a um eletrodo de cobre (Cu), em 1,0 L de solução de CuSO4(aq) à 0,01 mol L-1. Determine a energia gerada por esse conjunto, sabendo que os metais envolvidos apresentam os seguintes dados:
Cu2+(aq) + 2 e- --> Cu(s) E°red = +0,337 V
Pb2+ (aq) + 2 e- --> Pb(s) E°red = -0,133 V
Equação de Nernst:

ΔE = 0,496 V
ΔE = 1,500 V
ΔE = 0,230 V
ΔE = 0,444 V
ΔE = - 0,552 V
Sabendo-se que K é igual a 69 para a reação N2(g) + 3 H2(g) <===> 2 NH3(g) a 500 °C e que a análise de um recipiente de 7 L mostrou que a 500 °C se encontravam presentes, no estado de equilíbrio, 3,71 mols de hidrogênio e 4,55 mols de amoníaco, então o número de mols de nitrogênio presente no recipiente é:
0,288
0,414
0,510
0,653
0,144
O óxido de bário é usado na produção de certos tipos de vidros e na formação do meta arseniato de bário, de acordo com a equação seguir:
BaO + As2O5 ----> Ba3(AsO4)2
Após balancear, marque a alternativa que equivale à soma dos coeficientes estequiométricos:
10
12
4
5
6
Muitas misturas são feitas com vários compostos, formados por ligações diferentes. Em uma mistura que estão presentes água (H2O), sal comum (NaCl) e cloreto de cálcio (CaCl2) é um desses casos. Qual das alternativas contém o tipo correto de ligação que cada composto faz, respectivamente.
Iônica, covalente e covalente.
Covalente, covalente e iônica.
Covalente, iônica e covalente.
Iônica, iônica e iônica.
Covalente, iônica e iônica.
As ligações químicas tem a função principal de estabilizar os átomos envolvidos. Pode-se ter uma noção sobre essa estabilização através da "Teoria do Octeto". Dessa forma, uma molécula deve se formar para que os átomos envolvidos atinjam 8 elétrons na Camada de Valência, menos o hidrogênio que se estabiliza com 2 elétrons. Observe a molécula abaixo e determine qual deve ser o elemento X, para que o composto esteja corretamente representado:
Dados: P (Z = 15), S (Z = 16), C (Z = 6), N (Z = 7) e H (Z = 1).

Carbono.
Hidrogênio
Nitrogênio.
Enxofre.
Fósforo.
A água oxigenada comercial é uma solução de peróxido de hidrogênio (H2O2), fortemente anti-séptica, por liberar O2. O peróxido de hidrogênio é muito utilizado em reações químicas como agente oxidante, ou seja, provoca a oxidação de outros compostos. Os percentuais, em massa, de hidrogênio e oxigênio, nesse composto, são, respectivamente:

ΔE = 0,496 V
ΔE = 1,500 V
ΔE = 0,230 V
ΔE = 0,444 V
ΔE = - 0,552 V
Sabendo-se que K é igual a 69 para a reação N2(g) + 3 H2(g) <===> 2 NH3(g) a 500 °C e que a análise de um recipiente de 7 L mostrou que a 500 °C se encontravam presentes, no estado de equilíbrio, 3,71 mols de hidrogênio e 4,55 mols de amoníaco, então o número de mols de nitrogênio presente no recipiente é:
0,288
0,414
0,510
0,653
0,144
O óxido de bário é usado na produção de certos tipos de vidros e na formação do meta arseniato de bário, de acordo com a equação seguir:
BaO + As2O5 ----> Ba3(AsO4)2
Após balancear, marque a alternativa que equivale à soma dos coeficientes estequiométricos:
10
12
4
5
6
Muitas misturas são feitas com vários compostos, formados por ligações diferentes. Em uma mistura que estão presentes água (H2O), sal comum (NaCl) e cloreto de cálcio (CaCl2) é um desses casos. Qual das alternativas contém o tipo correto de ligação que cada composto faz, respectivamente.
Iônica, covalente e covalente.
Covalente, covalente e iônica.
Covalente, iônica e covalente.
Iônica, iônica e iônica.
Covalente, iônica e iônica.
As ligações químicas tem a função principal de estabilizar os átomos envolvidos. Pode-se ter uma noção sobre essa estabilização através da "Teoria do Octeto". Dessa forma, uma molécula deve se formar para que os átomos envolvidos atinjam 8 elétrons na Camada de Valência, menos o hidrogênio que se estabiliza com 2 elétrons. Observe a molécula abaixo e determine qual deve ser o elemento X, para que o composto esteja corretamente representado:
Dados: P (Z = 15), S (Z = 16), C (Z = 6), N (Z = 7) e H (Z = 1).

Carbono.
Hidrogênio
Nitrogênio.
Enxofre.
Fósforo.
A água oxigenada comercial é uma solução de peróxido de hidrogênio (H2O2), fortemente anti-séptica, por liberar O2. O peróxido de hidrogênio é muito utilizado em reações químicas como agente oxidante, ou seja, provoca a oxidação de outros compostos. Os percentuais, em massa, de hidrogênio e oxigênio, nesse composto, são, respectivamente:
0,288
0,414
0,510
0,653
0,144
O óxido de bário é usado na produção de certos tipos de vidros e na formação do meta arseniato de bário, de acordo com a equação seguir:
BaO + As2O5 ----> Ba3(AsO4)2
Após balancear, marque a alternativa que equivale à soma dos coeficientes estequiométricos:
10
12
4
5
6
Muitas misturas são feitas com vários compostos, formados por ligações diferentes. Em uma mistura que estão presentes água (H2O), sal comum (NaCl) e cloreto de cálcio (CaCl2) é um desses casos. Qual das alternativas contém o tipo correto de ligação que cada composto faz, respectivamente.
Iônica, covalente e covalente.
Covalente, covalente e iônica.
Covalente, iônica e covalente.
Iônica, iônica e iônica.
Covalente, iônica e iônica.
As ligações químicas tem a função principal de estabilizar os átomos envolvidos. Pode-se ter uma noção sobre essa estabilização através da "Teoria do Octeto". Dessa forma, uma molécula deve se formar para que os átomos envolvidos atinjam 8 elétrons na Camada de Valência, menos o hidrogênio que se estabiliza com 2 elétrons. Observe a molécula abaixo e determine qual deve ser o elemento X, para que o composto esteja corretamente representado:
Dados: P (Z = 15), S (Z = 16), C (Z = 6), N (Z = 7) e H (Z = 1).

Carbono.
Hidrogênio
Nitrogênio.
Enxofre.
Fósforo.
A água oxigenada comercial é uma solução de peróxido de hidrogênio (H2O2), fortemente anti-séptica, por liberar O2. O peróxido de hidrogênio é muito utilizado em reações químicas como agente oxidante, ou seja, provoca a oxidação de outros compostos. Os percentuais, em massa, de hidrogênio e oxigênio, nesse composto, são, respectivamente:
10
12
4
5
6
Muitas misturas são feitas com vários compostos, formados por ligações diferentes. Em uma mistura que estão presentes água (H2O), sal comum (NaCl) e cloreto de cálcio (CaCl2) é um desses casos. Qual das alternativas contém o tipo correto de ligação que cada composto faz, respectivamente.
Iônica, covalente e covalente.
Covalente, covalente e iônica.
Covalente, iônica e covalente.
Iônica, iônica e iônica.
Covalente, iônica e iônica.
As ligações químicas tem a função principal de estabilizar os átomos envolvidos. Pode-se ter uma noção sobre essa estabilização através da "Teoria do Octeto". Dessa forma, uma molécula deve se formar para que os átomos envolvidos atinjam 8 elétrons na Camada de Valência, menos o hidrogênio que se estabiliza com 2 elétrons. Observe a molécula abaixo e determine qual deve ser o elemento X, para que o composto esteja corretamente representado:
Dados: P (Z = 15), S (Z = 16), C (Z = 6), N (Z = 7) e H (Z = 1).

Carbono.
Hidrogênio
Nitrogênio.
Enxofre.
Fósforo.
A água oxigenada comercial é uma solução de peróxido de hidrogênio (H2O2), fortemente anti-séptica, por liberar O2. O peróxido de hidrogênio é muito utilizado em reações químicas como agente oxidante, ou seja, provoca a oxidação de outros compostos. Os percentuais, em massa, de hidrogênio e oxigênio, nesse composto, são, respectivamente:
Iônica, covalente e covalente.
Covalente, covalente e iônica.
Covalente, iônica e covalente.
Iônica, iônica e iônica.
Covalente, iônica e iônica.
As ligações químicas tem a função principal de estabilizar os átomos envolvidos. Pode-se ter uma noção sobre essa estabilização através da "Teoria do Octeto". Dessa forma, uma molécula deve se formar para que os átomos envolvidos atinjam 8 elétrons na Camada de Valência, menos o hidrogênio que se estabiliza com 2 elétrons. Observe a molécula abaixo e determine qual deve ser o elemento X, para que o composto esteja corretamente representado:
Dados: P (Z = 15), S (Z = 16), C (Z = 6), N (Z = 7) e H (Z = 1).

Carbono.
Hidrogênio
Nitrogênio.
Enxofre.
Fósforo.
A água oxigenada comercial é uma solução de peróxido de hidrogênio (H2O2), fortemente anti-séptica, por liberar O2. O peróxido de hidrogênio é muito utilizado em reações químicas como agente oxidante, ou seja, provoca a oxidação de outros compostos. Os percentuais, em massa, de hidrogênio e oxigênio, nesse composto, são, respectivamente:

Carbono.
Hidrogênio
Nitrogênio.
Enxofre.
Fósforo.