QUÍMICA ORGÂNICA II
Os compostos orgânicos, quando em meio aquoso, podem ou não apresentar solubilidade em água. Quando são solúveis, transferem suas propriedades para o meio, conferindo alterações das propriedades e até mesmo do pH da solução. Alguns compostos podem gerar propriedades ácidas, como os ácidos carboxílicos. Considere os ácidos carboxílicos abaixo:
I Cl3C-CO2H
II CH3-CO2H
III CH3-CH2-CH2-CO2H
IV HCO2H
A opção que representa corretamente a ordem crescente de acidez é:
I, III, IV, II.
III, I, II, IV.
III, II, IV, I.
IV, II, III, I.
I, IV, II. III.
Os ácidos carboxílicos são compostos orgânicos que apresentam o mais pronunciado caráter ácido, muito embora sejam considerados ácidos fracos. Quando em solução aquosa, liberam íon hidrônio ou hidroxônio, como a reação a seguir:
 Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Propanóico.
Monocloro acético.
γ-iodo pentanóico.
Benzóico.
β-cloro butanóico.
Em toda reação química é necessário que aconteça a quebra de uma ligação para formação de outra substância. Essa quebra pode acontecer de duas formas: cisão homolítica e heterolítica. Sobre essas duas formas de quebra de ligação, marque a alternativa correta.
Na cisão heterolítica, o par de elétrons da ligação ficará com apenas uma das espécies.
Na cisão heterolítica, pode ocorrer a formação de espécies radicalares.
A cisão homolítica é mais comum de acontecer que a cisão heterolítica.
Na cisão homolítica, o par de elétrons da ligação ficará com apenas um átomo que compõe a ligação.
Na cisão heterolítica, o par de elétrons da ligação é dividido entre os átomos que compõe a ligação.
Os anidridos de ácidos carboxílicos são compostos que apresentam em sua estrutura química um átomo de oxigênio ligado a dois grupos carbonílicos com dois radicais orgânicos. Sobre os anidridos, marque a alternativa correta.
Se as duas moléculas de ácido carboxílico que formam o anidrido forem iguais, o anidrido será chamado de assimétrico.
Se as duas moléculas de ácido carboxílico que formam o anidrido forem diferentes, o anidrido será chamado de simétrico.
A palavra anidrido significa com água.
Os anidridos simétricos são nomeados pelo nome do ácido carboxílico correspondente.
Os anidridos mistos são nomeados mantendo o nome de apenas um ácido carboxílico.
Considerando a teoria de Bronsted-Lowry, ácido é toda espécie capaz de doar próton (H+) e base é toda espécie química capaz de receber próton (H+). Na reação a seguir:
NH3 + H2O ↔ NH4+ + OH- Quais espécies podem ser consideradas bases de Bronsted-Lowry?
NH3 e NH4+
H3O+ e OH
H2O e NH4+
NH3 e H3O+
NH3 e OH
A reação de adição de um hidreto a um aldeído ou cetona forma um íon alcóxido, que em seguida, sofre protonação levando a formação de um álcool. A reação entre o composto X com boroidreto de sódio produz como resultado um composto de fórmula molecular C4H10O. A alternativa que substitui o composto X corretamente é:
C4H8O
C4H10O2
C4H6O
C4H9O
C3H10O
A basicidade das aminas está relacionada com a disponibilidade do par de elétrons do nitrogênio a ser doado para outra espécie, sendo assim, quanto mais disponível o par de elétrons, mais básica é a amina. Porém, quando estamos trabalhando com aminas aromáticas, o efeito de ressonância faz com que os pares de elétrons fiquem menos disponíveis o que diminui a basicidade das mesmas. Dentre as aminas descritas nas alternativas, qual terá o maior caráter básico?
Fenilamina
Trifenilamina
Fenil-metilamina
Metilamina
Dimetilamina
Para compreender as reações químicas orgânicas, devemos conhecer primeiramente alguns conceitos básicos, como diferenciar nucleófilos de eletrófilos. Sendo assim, analisando as espécies químicas a seguir:
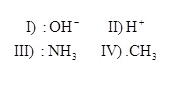 Podemos dizer que estas podem ser classificadas, respectivamente, como:
Podemos dizer que estas podem ser classificadas, respectivamente, como:
Reagente eletrófilo, reagente nucleófilo, reagente nucleófilo, radical livre.
Reagente nucleófilo, reagente eletrófilo, reagente nucleófilo, radical livre.
Reagente eletrófilo, radical livre, reagente nucleófilo, reagente nucleófilo.
Radical livre, reagente nucleófilo, reagente nucleófilo, reagente eletrófilo.
Reagente nucleófilo, radical livre, reagente nucleófilo, reagente eletrófilo.
Os valores Ka e pKa indicam a força ácida de um determinado composto. Quanto menor o valor de pKa, maior será seu valor de Ka e consequentemente maior é a força ácida da substância. Considere a tabela a seguir, que apresenta os valores de pKa e da temperatura de ebulição de três compostos.

Os compostos A, B e C podem ser, respectivamente:
ácido acético - fenol - etanol.
fenol - ácido acético - etanol.
etanol - fenol - ácido acético.
ácido acético - etanol - fenol.
fenol - etanol - ácido acético.
Os ácidos orgânicos e os fenóis possuem caráter ácido, ou seja, ionizam liberando íons H+ quando em solução aquosa. Mas quando comparados aos ácidos inorgânicos, são bem mais fracos. No entanto, a presença de determinados grupos ligados ao átomo de carbono, provoca um aumento na ionização do composto. Considere uma substância representada pela estrutura abaixo:
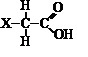 A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:
A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:
I, III, IV, II.
III, I, II, IV.
III, II, IV, I.
IV, II, III, I.
I, IV, II. III.
Os ácidos carboxílicos são compostos orgânicos que apresentam o mais pronunciado caráter ácido, muito embora sejam considerados ácidos fracos. Quando em solução aquosa, liberam íon hidrônio ou hidroxônio, como a reação a seguir:
 Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Propanóico.
Monocloro acético.
γ-iodo pentanóico.
Benzóico.
β-cloro butanóico.
Em toda reação química é necessário que aconteça a quebra de uma ligação para formação de outra substância. Essa quebra pode acontecer de duas formas: cisão homolítica e heterolítica. Sobre essas duas formas de quebra de ligação, marque a alternativa correta.
Na cisão heterolítica, o par de elétrons da ligação ficará com apenas uma das espécies.
Na cisão heterolítica, pode ocorrer a formação de espécies radicalares.
A cisão homolítica é mais comum de acontecer que a cisão heterolítica.
Na cisão homolítica, o par de elétrons da ligação ficará com apenas um átomo que compõe a ligação.
Na cisão heterolítica, o par de elétrons da ligação é dividido entre os átomos que compõe a ligação.
Os anidridos de ácidos carboxílicos são compostos que apresentam em sua estrutura química um átomo de oxigênio ligado a dois grupos carbonílicos com dois radicais orgânicos. Sobre os anidridos, marque a alternativa correta.
Se as duas moléculas de ácido carboxílico que formam o anidrido forem iguais, o anidrido será chamado de assimétrico.
Se as duas moléculas de ácido carboxílico que formam o anidrido forem diferentes, o anidrido será chamado de simétrico.
A palavra anidrido significa com água.
Os anidridos simétricos são nomeados pelo nome do ácido carboxílico correspondente.
Os anidridos mistos são nomeados mantendo o nome de apenas um ácido carboxílico.
Considerando a teoria de Bronsted-Lowry, ácido é toda espécie capaz de doar próton (H+) e base é toda espécie química capaz de receber próton (H+). Na reação a seguir:
NH3 + H2O ↔ NH4+ + OH- Quais espécies podem ser consideradas bases de Bronsted-Lowry?
NH3 e NH4+
H3O+ e OH
H2O e NH4+
NH3 e H3O+
NH3 e OH
A reação de adição de um hidreto a um aldeído ou cetona forma um íon alcóxido, que em seguida, sofre protonação levando a formação de um álcool. A reação entre o composto X com boroidreto de sódio produz como resultado um composto de fórmula molecular C4H10O. A alternativa que substitui o composto X corretamente é:
C4H8O
C4H10O2
C4H6O
C4H9O
C3H10O
A basicidade das aminas está relacionada com a disponibilidade do par de elétrons do nitrogênio a ser doado para outra espécie, sendo assim, quanto mais disponível o par de elétrons, mais básica é a amina. Porém, quando estamos trabalhando com aminas aromáticas, o efeito de ressonância faz com que os pares de elétrons fiquem menos disponíveis o que diminui a basicidade das mesmas. Dentre as aminas descritas nas alternativas, qual terá o maior caráter básico?
Fenilamina
Trifenilamina
Fenil-metilamina
Metilamina
Dimetilamina
Para compreender as reações químicas orgânicas, devemos conhecer primeiramente alguns conceitos básicos, como diferenciar nucleófilos de eletrófilos. Sendo assim, analisando as espécies químicas a seguir:
 Podemos dizer que estas podem ser classificadas, respectivamente, como:
Podemos dizer que estas podem ser classificadas, respectivamente, como:
Reagente eletrófilo, reagente nucleófilo, reagente nucleófilo, radical livre.
Reagente nucleófilo, reagente eletrófilo, reagente nucleófilo, radical livre.
Reagente eletrófilo, radical livre, reagente nucleófilo, reagente nucleófilo.
Radical livre, reagente nucleófilo, reagente nucleófilo, reagente eletrófilo.
Reagente nucleófilo, radical livre, reagente nucleófilo, reagente eletrófilo.
Os valores Ka e pKa indicam a força ácida de um determinado composto. Quanto menor o valor de pKa, maior será seu valor de Ka e consequentemente maior é a força ácida da substância. Considere a tabela a seguir, que apresenta os valores de pKa e da temperatura de ebulição de três compostos.

Os compostos A, B e C podem ser, respectivamente:
ácido acético - fenol - etanol.
fenol - ácido acético - etanol.
etanol - fenol - ácido acético.
ácido acético - etanol - fenol.
fenol - etanol - ácido acético.
Os ácidos orgânicos e os fenóis possuem caráter ácido, ou seja, ionizam liberando íons H+ quando em solução aquosa. Mas quando comparados aos ácidos inorgânicos, são bem mais fracos. No entanto, a presença de determinados grupos ligados ao átomo de carbono, provoca um aumento na ionização do composto. Considere uma substância representada pela estrutura abaixo:
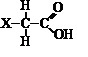 A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:
A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:
Propanóico.
Monocloro acético.
γ-iodo pentanóico.
Benzóico.
β-cloro butanóico.
Em toda reação química é necessário que aconteça a quebra de uma ligação para formação de outra substância. Essa quebra pode acontecer de duas formas: cisão homolítica e heterolítica. Sobre essas duas formas de quebra de ligação, marque a alternativa correta.
Na cisão heterolítica, o par de elétrons da ligação ficará com apenas uma das espécies.
Na cisão heterolítica, pode ocorrer a formação de espécies radicalares.
A cisão homolítica é mais comum de acontecer que a cisão heterolítica.
Na cisão homolítica, o par de elétrons da ligação ficará com apenas um átomo que compõe a ligação.
Na cisão heterolítica, o par de elétrons da ligação é dividido entre os átomos que compõe a ligação.
Os anidridos de ácidos carboxílicos são compostos que apresentam em sua estrutura química um átomo de oxigênio ligado a dois grupos carbonílicos com dois radicais orgânicos. Sobre os anidridos, marque a alternativa correta.
Se as duas moléculas de ácido carboxílico que formam o anidrido forem iguais, o anidrido será chamado de assimétrico.
Se as duas moléculas de ácido carboxílico que formam o anidrido forem diferentes, o anidrido será chamado de simétrico.
A palavra anidrido significa com água.
Os anidridos simétricos são nomeados pelo nome do ácido carboxílico correspondente.
Os anidridos mistos são nomeados mantendo o nome de apenas um ácido carboxílico.
Considerando a teoria de Bronsted-Lowry, ácido é toda espécie capaz de doar próton (H+) e base é toda espécie química capaz de receber próton (H+). Na reação a seguir:
NH3 + H2O ↔ NH4+ + OH- Quais espécies podem ser consideradas bases de Bronsted-Lowry?
NH3 e NH4+
H3O+ e OH
H2O e NH4+
NH3 e H3O+
NH3 e OH
A reação de adição de um hidreto a um aldeído ou cetona forma um íon alcóxido, que em seguida, sofre protonação levando a formação de um álcool. A reação entre o composto X com boroidreto de sódio produz como resultado um composto de fórmula molecular C4H10O. A alternativa que substitui o composto X corretamente é:
C4H8O
C4H10O2
C4H6O
C4H9O
C3H10O
A basicidade das aminas está relacionada com a disponibilidade do par de elétrons do nitrogênio a ser doado para outra espécie, sendo assim, quanto mais disponível o par de elétrons, mais básica é a amina. Porém, quando estamos trabalhando com aminas aromáticas, o efeito de ressonância faz com que os pares de elétrons fiquem menos disponíveis o que diminui a basicidade das mesmas. Dentre as aminas descritas nas alternativas, qual terá o maior caráter básico?
Fenilamina
Trifenilamina
Fenil-metilamina
Metilamina
Dimetilamina
Para compreender as reações químicas orgânicas, devemos conhecer primeiramente alguns conceitos básicos, como diferenciar nucleófilos de eletrófilos. Sendo assim, analisando as espécies químicas a seguir:
 Podemos dizer que estas podem ser classificadas, respectivamente, como:
Podemos dizer que estas podem ser classificadas, respectivamente, como:
Reagente eletrófilo, reagente nucleófilo, reagente nucleófilo, radical livre.
Reagente nucleófilo, reagente eletrófilo, reagente nucleófilo, radical livre.
Reagente eletrófilo, radical livre, reagente nucleófilo, reagente nucleófilo.
Radical livre, reagente nucleófilo, reagente nucleófilo, reagente eletrófilo.
Reagente nucleófilo, radical livre, reagente nucleófilo, reagente eletrófilo.
Os valores Ka e pKa indicam a força ácida de um determinado composto. Quanto menor o valor de pKa, maior será seu valor de Ka e consequentemente maior é a força ácida da substância. Considere a tabela a seguir, que apresenta os valores de pKa e da temperatura de ebulição de três compostos.

Os compostos A, B e C podem ser, respectivamente:
ácido acético - fenol - etanol.
fenol - ácido acético - etanol.
etanol - fenol - ácido acético.
ácido acético - etanol - fenol.
fenol - etanol - ácido acético.
Os ácidos orgânicos e os fenóis possuem caráter ácido, ou seja, ionizam liberando íons H+ quando em solução aquosa. Mas quando comparados aos ácidos inorgânicos, são bem mais fracos. No entanto, a presença de determinados grupos ligados ao átomo de carbono, provoca um aumento na ionização do composto. Considere uma substância representada pela estrutura abaixo:
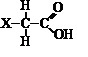 A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:
A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:
Na cisão heterolítica, o par de elétrons da ligação ficará com apenas uma das espécies.
Na cisão heterolítica, pode ocorrer a formação de espécies radicalares.
A cisão homolítica é mais comum de acontecer que a cisão heterolítica.
Na cisão homolítica, o par de elétrons da ligação ficará com apenas um átomo que compõe a ligação.
Na cisão heterolítica, o par de elétrons da ligação é dividido entre os átomos que compõe a ligação.
Os anidridos de ácidos carboxílicos são compostos que apresentam em sua estrutura química um átomo de oxigênio ligado a dois grupos carbonílicos com dois radicais orgânicos. Sobre os anidridos, marque a alternativa correta.
Se as duas moléculas de ácido carboxílico que formam o anidrido forem iguais, o anidrido será chamado de assimétrico.
Se as duas moléculas de ácido carboxílico que formam o anidrido forem diferentes, o anidrido será chamado de simétrico.
A palavra anidrido significa com água.
Os anidridos simétricos são nomeados pelo nome do ácido carboxílico correspondente.
Os anidridos mistos são nomeados mantendo o nome de apenas um ácido carboxílico.
Considerando a teoria de Bronsted-Lowry, ácido é toda espécie capaz de doar próton (H+) e base é toda espécie química capaz de receber próton (H+). Na reação a seguir:
NH3 + H2O ↔ NH4+ + OH- Quais espécies podem ser consideradas bases de Bronsted-Lowry?
NH3 e NH4+
H3O+ e OH
H2O e NH4+
NH3 e H3O+
NH3 e OH
A reação de adição de um hidreto a um aldeído ou cetona forma um íon alcóxido, que em seguida, sofre protonação levando a formação de um álcool. A reação entre o composto X com boroidreto de sódio produz como resultado um composto de fórmula molecular C4H10O. A alternativa que substitui o composto X corretamente é:
C4H8O
C4H10O2
C4H6O
C4H9O
C3H10O
A basicidade das aminas está relacionada com a disponibilidade do par de elétrons do nitrogênio a ser doado para outra espécie, sendo assim, quanto mais disponível o par de elétrons, mais básica é a amina. Porém, quando estamos trabalhando com aminas aromáticas, o efeito de ressonância faz com que os pares de elétrons fiquem menos disponíveis o que diminui a basicidade das mesmas. Dentre as aminas descritas nas alternativas, qual terá o maior caráter básico?
Fenilamina
Trifenilamina
Fenil-metilamina
Metilamina
Dimetilamina
Para compreender as reações químicas orgânicas, devemos conhecer primeiramente alguns conceitos básicos, como diferenciar nucleófilos de eletrófilos. Sendo assim, analisando as espécies químicas a seguir:
 Podemos dizer que estas podem ser classificadas, respectivamente, como:
Podemos dizer que estas podem ser classificadas, respectivamente, como:
Reagente eletrófilo, reagente nucleófilo, reagente nucleófilo, radical livre.
Reagente nucleófilo, reagente eletrófilo, reagente nucleófilo, radical livre.
Reagente eletrófilo, radical livre, reagente nucleófilo, reagente nucleófilo.
Radical livre, reagente nucleófilo, reagente nucleófilo, reagente eletrófilo.
Reagente nucleófilo, radical livre, reagente nucleófilo, reagente eletrófilo.
Os valores Ka e pKa indicam a força ácida de um determinado composto. Quanto menor o valor de pKa, maior será seu valor de Ka e consequentemente maior é a força ácida da substância. Considere a tabela a seguir, que apresenta os valores de pKa e da temperatura de ebulição de três compostos.

Os compostos A, B e C podem ser, respectivamente:
ácido acético - fenol - etanol.
fenol - ácido acético - etanol.
etanol - fenol - ácido acético.
ácido acético - etanol - fenol.
fenol - etanol - ácido acético.
Os ácidos orgânicos e os fenóis possuem caráter ácido, ou seja, ionizam liberando íons H+ quando em solução aquosa. Mas quando comparados aos ácidos inorgânicos, são bem mais fracos. No entanto, a presença de determinados grupos ligados ao átomo de carbono, provoca um aumento na ionização do composto. Considere uma substância representada pela estrutura abaixo:
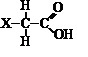 A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:
A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:
Se as duas moléculas de ácido carboxílico que formam o anidrido forem iguais, o anidrido será chamado de assimétrico.
Se as duas moléculas de ácido carboxílico que formam o anidrido forem diferentes, o anidrido será chamado de simétrico.
A palavra anidrido significa com água.
Os anidridos simétricos são nomeados pelo nome do ácido carboxílico correspondente.
Os anidridos mistos são nomeados mantendo o nome de apenas um ácido carboxílico.
Considerando a teoria de Bronsted-Lowry, ácido é toda espécie capaz de doar próton (H+) e base é toda espécie química capaz de receber próton (H+). Na reação a seguir:
NH3 + H2O ↔ NH4+ + OH- Quais espécies podem ser consideradas bases de Bronsted-Lowry?
NH3 e NH4+
H3O+ e OH
H2O e NH4+
NH3 e H3O+
NH3 e OH
A reação de adição de um hidreto a um aldeído ou cetona forma um íon alcóxido, que em seguida, sofre protonação levando a formação de um álcool. A reação entre o composto X com boroidreto de sódio produz como resultado um composto de fórmula molecular C4H10O. A alternativa que substitui o composto X corretamente é:
C4H8O
C4H10O2
C4H6O
C4H9O
C3H10O
A basicidade das aminas está relacionada com a disponibilidade do par de elétrons do nitrogênio a ser doado para outra espécie, sendo assim, quanto mais disponível o par de elétrons, mais básica é a amina. Porém, quando estamos trabalhando com aminas aromáticas, o efeito de ressonância faz com que os pares de elétrons fiquem menos disponíveis o que diminui a basicidade das mesmas. Dentre as aminas descritas nas alternativas, qual terá o maior caráter básico?
Fenilamina
Trifenilamina
Fenil-metilamina
Metilamina
Dimetilamina
Para compreender as reações químicas orgânicas, devemos conhecer primeiramente alguns conceitos básicos, como diferenciar nucleófilos de eletrófilos. Sendo assim, analisando as espécies químicas a seguir:
 Podemos dizer que estas podem ser classificadas, respectivamente, como:
Podemos dizer que estas podem ser classificadas, respectivamente, como:
Reagente eletrófilo, reagente nucleófilo, reagente nucleófilo, radical livre.
Reagente nucleófilo, reagente eletrófilo, reagente nucleófilo, radical livre.
Reagente eletrófilo, radical livre, reagente nucleófilo, reagente nucleófilo.
Radical livre, reagente nucleófilo, reagente nucleófilo, reagente eletrófilo.
Reagente nucleófilo, radical livre, reagente nucleófilo, reagente eletrófilo.
Os valores Ka e pKa indicam a força ácida de um determinado composto. Quanto menor o valor de pKa, maior será seu valor de Ka e consequentemente maior é a força ácida da substância. Considere a tabela a seguir, que apresenta os valores de pKa e da temperatura de ebulição de três compostos.

Os compostos A, B e C podem ser, respectivamente:
ácido acético - fenol - etanol.
fenol - ácido acético - etanol.
etanol - fenol - ácido acético.
ácido acético - etanol - fenol.
fenol - etanol - ácido acético.
Os ácidos orgânicos e os fenóis possuem caráter ácido, ou seja, ionizam liberando íons H+ quando em solução aquosa. Mas quando comparados aos ácidos inorgânicos, são bem mais fracos. No entanto, a presença de determinados grupos ligados ao átomo de carbono, provoca um aumento na ionização do composto. Considere uma substância representada pela estrutura abaixo:
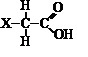 A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:
A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:
NH3 e NH4+
H3O+ e OH
H2O e NH4+
NH3 e H3O+
NH3 e OH
A reação de adição de um hidreto a um aldeído ou cetona forma um íon alcóxido, que em seguida, sofre protonação levando a formação de um álcool. A reação entre o composto X com boroidreto de sódio produz como resultado um composto de fórmula molecular C4H10O. A alternativa que substitui o composto X corretamente é:
C4H8O
C4H10O2
C4H6O
C4H9O
C3H10O
A basicidade das aminas está relacionada com a disponibilidade do par de elétrons do nitrogênio a ser doado para outra espécie, sendo assim, quanto mais disponível o par de elétrons, mais básica é a amina. Porém, quando estamos trabalhando com aminas aromáticas, o efeito de ressonância faz com que os pares de elétrons fiquem menos disponíveis o que diminui a basicidade das mesmas. Dentre as aminas descritas nas alternativas, qual terá o maior caráter básico?
Fenilamina
Trifenilamina
Fenil-metilamina
Metilamina
Dimetilamina
Para compreender as reações químicas orgânicas, devemos conhecer primeiramente alguns conceitos básicos, como diferenciar nucleófilos de eletrófilos. Sendo assim, analisando as espécies químicas a seguir:
 Podemos dizer que estas podem ser classificadas, respectivamente, como:
Podemos dizer que estas podem ser classificadas, respectivamente, como:
Reagente eletrófilo, reagente nucleófilo, reagente nucleófilo, radical livre.
Reagente nucleófilo, reagente eletrófilo, reagente nucleófilo, radical livre.
Reagente eletrófilo, radical livre, reagente nucleófilo, reagente nucleófilo.
Radical livre, reagente nucleófilo, reagente nucleófilo, reagente eletrófilo.
Reagente nucleófilo, radical livre, reagente nucleófilo, reagente eletrófilo.
Os valores Ka e pKa indicam a força ácida de um determinado composto. Quanto menor o valor de pKa, maior será seu valor de Ka e consequentemente maior é a força ácida da substância. Considere a tabela a seguir, que apresenta os valores de pKa e da temperatura de ebulição de três compostos.

Os compostos A, B e C podem ser, respectivamente:
ácido acético - fenol - etanol.
fenol - ácido acético - etanol.
etanol - fenol - ácido acético.
ácido acético - etanol - fenol.
fenol - etanol - ácido acético.
Os ácidos orgânicos e os fenóis possuem caráter ácido, ou seja, ionizam liberando íons H+ quando em solução aquosa. Mas quando comparados aos ácidos inorgânicos, são bem mais fracos. No entanto, a presença de determinados grupos ligados ao átomo de carbono, provoca um aumento na ionização do composto. Considere uma substância representada pela estrutura abaixo:
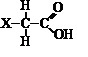 A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:
A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:
C4H8O
C4H10O2
C4H6O
C4H9O
C3H10O
A basicidade das aminas está relacionada com a disponibilidade do par de elétrons do nitrogênio a ser doado para outra espécie, sendo assim, quanto mais disponível o par de elétrons, mais básica é a amina. Porém, quando estamos trabalhando com aminas aromáticas, o efeito de ressonância faz com que os pares de elétrons fiquem menos disponíveis o que diminui a basicidade das mesmas. Dentre as aminas descritas nas alternativas, qual terá o maior caráter básico?
Fenilamina
Trifenilamina
Fenil-metilamina
Metilamina
Dimetilamina
Para compreender as reações químicas orgânicas, devemos conhecer primeiramente alguns conceitos básicos, como diferenciar nucleófilos de eletrófilos. Sendo assim, analisando as espécies químicas a seguir:
 Podemos dizer que estas podem ser classificadas, respectivamente, como:
Podemos dizer que estas podem ser classificadas, respectivamente, como:
Reagente eletrófilo, reagente nucleófilo, reagente nucleófilo, radical livre.
Reagente nucleófilo, reagente eletrófilo, reagente nucleófilo, radical livre.
Reagente eletrófilo, radical livre, reagente nucleófilo, reagente nucleófilo.
Radical livre, reagente nucleófilo, reagente nucleófilo, reagente eletrófilo.
Reagente nucleófilo, radical livre, reagente nucleófilo, reagente eletrófilo.
Os valores Ka e pKa indicam a força ácida de um determinado composto. Quanto menor o valor de pKa, maior será seu valor de Ka e consequentemente maior é a força ácida da substância. Considere a tabela a seguir, que apresenta os valores de pKa e da temperatura de ebulição de três compostos.

Os compostos A, B e C podem ser, respectivamente:
ácido acético - fenol - etanol.
fenol - ácido acético - etanol.
etanol - fenol - ácido acético.
ácido acético - etanol - fenol.
fenol - etanol - ácido acético.
Os ácidos orgânicos e os fenóis possuem caráter ácido, ou seja, ionizam liberando íons H+ quando em solução aquosa. Mas quando comparados aos ácidos inorgânicos, são bem mais fracos. No entanto, a presença de determinados grupos ligados ao átomo de carbono, provoca um aumento na ionização do composto. Considere uma substância representada pela estrutura abaixo:
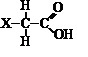 A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:
A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:
Fenilamina
Trifenilamina
Fenil-metilamina
Metilamina
Dimetilamina
Para compreender as reações químicas orgânicas, devemos conhecer primeiramente alguns conceitos básicos, como diferenciar nucleófilos de eletrófilos. Sendo assim, analisando as espécies químicas a seguir:
 Podemos dizer que estas podem ser classificadas, respectivamente, como:
Podemos dizer que estas podem ser classificadas, respectivamente, como:
Reagente eletrófilo, reagente nucleófilo, reagente nucleófilo, radical livre.
Reagente nucleófilo, reagente eletrófilo, reagente nucleófilo, radical livre.
Reagente eletrófilo, radical livre, reagente nucleófilo, reagente nucleófilo.
Radical livre, reagente nucleófilo, reagente nucleófilo, reagente eletrófilo.
Reagente nucleófilo, radical livre, reagente nucleófilo, reagente eletrófilo.
Os valores Ka e pKa indicam a força ácida de um determinado composto. Quanto menor o valor de pKa, maior será seu valor de Ka e consequentemente maior é a força ácida da substância. Considere a tabela a seguir, que apresenta os valores de pKa e da temperatura de ebulição de três compostos.

Os compostos A, B e C podem ser, respectivamente:
ácido acético - fenol - etanol.
fenol - ácido acético - etanol.
etanol - fenol - ácido acético.
ácido acético - etanol - fenol.
fenol - etanol - ácido acético.
Os ácidos orgânicos e os fenóis possuem caráter ácido, ou seja, ionizam liberando íons H+ quando em solução aquosa. Mas quando comparados aos ácidos inorgânicos, são bem mais fracos. No entanto, a presença de determinados grupos ligados ao átomo de carbono, provoca um aumento na ionização do composto. Considere uma substância representada pela estrutura abaixo:
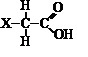 A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:
A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:
Reagente eletrófilo, reagente nucleófilo, reagente nucleófilo, radical livre.
Reagente nucleófilo, reagente eletrófilo, reagente nucleófilo, radical livre.
Reagente eletrófilo, radical livre, reagente nucleófilo, reagente nucleófilo.
Radical livre, reagente nucleófilo, reagente nucleófilo, reagente eletrófilo.
Reagente nucleófilo, radical livre, reagente nucleófilo, reagente eletrófilo.
Os valores Ka e pKa indicam a força ácida de um determinado composto. Quanto menor o valor de pKa, maior será seu valor de Ka e consequentemente maior é a força ácida da substância. Considere a tabela a seguir, que apresenta os valores de pKa e da temperatura de ebulição de três compostos.

Os compostos A, B e C podem ser, respectivamente:
ácido acético - fenol - etanol.
fenol - ácido acético - etanol.
etanol - fenol - ácido acético.
ácido acético - etanol - fenol.
fenol - etanol - ácido acético.
Os ácidos orgânicos e os fenóis possuem caráter ácido, ou seja, ionizam liberando íons H+ quando em solução aquosa. Mas quando comparados aos ácidos inorgânicos, são bem mais fracos. No entanto, a presença de determinados grupos ligados ao átomo de carbono, provoca um aumento na ionização do composto. Considere uma substância representada pela estrutura abaixo:
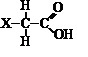 A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:
A substância acima estará mais ionizada em solução aquosa se X representar o grupo substituinte:

ácido acético - fenol - etanol.
fenol - ácido acético - etanol.
etanol - fenol - ácido acético.
ácido acético - etanol - fenol.
fenol - etanol - ácido acético.