QUÍMICA ANALÍTICA II
Após fazer a titulação de 25,0 mililitros de uma solução 0,10 mol/L do ácido CH3COOH, utilizando uma solução de NaOH 0,10 mol/L, obteve-se o gráfico abaixo:
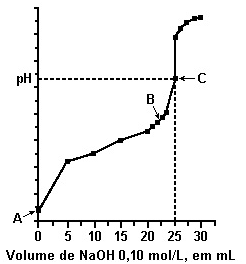
Com base nos dados apresentados neste gráfico foram feitas as afirmações:
I. O ponto A corresponde ao pH da solução inicial do ácido, sendo igual a 1.
II. O ponto B corresponde à neutralização parcial do ácido, e a solução resultante é um tampão.
III. O ponto C corresponde ao ponto de neutralização do ácido pela base, sendo seu pH maior que 7.
É correto o que se afirma em
I, apenas
I, II e III
I e II, apenas
II e III, apenas
II, apenas
O rótulo de um produto de limpeza diz que a concentração de amônia (NH3) é de 9,5 g/L. Com o intuito de verificar se a concentração de amônia corresponde à indicada no rótulo, 5,00 mL desse produto foram titulados com ácido clorídrico de concentração 0,100 mol/L. Para consumir toda a amônia dessa amostra, foram gastos 25,00 m/L do ácido.
(Dados: H = 1, N = 14 e Cl = 35,5.) Com base nas informações fornecidas acima:
Qual a concentração da solução, calculada com os dados da titulação? A concentração indicada no rótulo é correta?
0,50 mol/L – não
0,25 mol/L – sim
0,50 mol/L – sim
0,25 mol/L – não
0,12 mol/L – sim
O gráfico abaixo demonstra a curva de pH, criada à partir de uma titulação de um ácido e uma base. Baseado nas características da curva, podemos afirmar que as substâncias envolvidas nessa titulação de neutralização são:
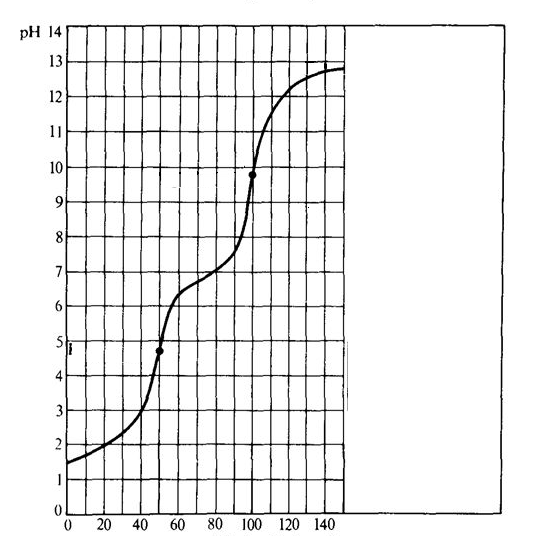
Titulante: HCl ; Titulado: Mg(OH)2
Titulante: NaOH ; Titulado: HCl
Titulante: Ba(OH)2 ; Titulado: HCl
Titulante: H3PO4 ; Titulado: NaOH
Titulante: NaOH ; Titulado: H2SO4
A titulação de 50mL de uma base forte com ácido forte 0,1mol/L, que reagem com estequiometria 1:1, pode ser representada através do gráfico, onde P.E. = ponto de equivalência.
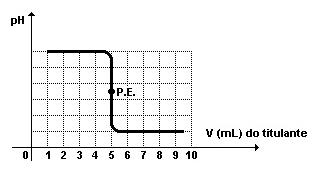
Considerando a informação dada, assinale a alternativa correta.
O pH no P.E. é 12,0
A concentração da base é 0,05 mol/L
O pH da base é 12,7
A concentração da base é 1,0 mol/L
A concentração da base é 0,01 mol/L
Com o objetivo de determinar a concentração molar de uma solução aquosa de NaOH, um analista químico procedeu a titulação de 50 mL dessa solução com solução aquosa de H2SO4 0,10 molar, consumindo na equivalência, 25 mL do titulante. A concentração molar solução analisada, é:
0,05
0,25
0,10
0,20
0,15
Uma alíquota de 100,0 mL de uma amostra de água contendo Ca(II) e Mg(II) é titulada com 22,74 mL de EDTA 0,00998 mols/L em pH 10,0. Outra alíquota de 100,0 mL da mesma amostra é tratada com NaOH para precipitar Mg(OH)2 e é então titulada em pH 13 com 15,86 mL da mesma solução de EDTA. Calcule a dureza total (mg/L de CaCO3). Dados: CaCO3 = 100,09 g/mol
573,65 mg/L de CaCO3
226,94 mg/L de CaCO3
345,39 mg/L de CaCO3
984,54 mg/L de CaCO3
653,89 mg/L de CaCO3
Para um químico analítico, determinar a concentração de íons metálicos em soluções aquosas é muito importante. Com esse objetivo um aluno do curso de licenciatura em química misturou duas soluções padrões de Zn2+ e Ca2+. De forma que agora terá que determinar a concentração de cada espécie na solução. Para isso o aluno fez uma titulação utilizando 50 mL de amostra da mistura gastando 28,11 mL de outra solução padrão de EDTA 0,01381 M. Outra alíquota da amostra de igual volume foi tratada com uma solução de KCN para mascarar o zinco presente na amostra. Assim procedeu-se a titulação com a mesma solução de EDTA tendo gasto 14,38 mL de solução. Qual foi a concentração de Zn2+ encontrada na amostra?
[Zn2+] = 3,81 . 10-3 mol/L
[Zn2+] = 3,81 . 10-5 mol/L
[Zn2+] = 3,81 . 10-2 mol/L
[Zn2+] = 3,81 . 10-1 mol/L
[Zn2+] = 3,81 . 10-4 mol/L
Uma das aplicações da titulometria de complexação é a determinação da concentração de um agente como o EDTA. Para esse fim utiliza-se um reagente de padrão analítico como o carbonato de magnésio. Uma amostra de 0,136 g de MgCO3 foi pesado em balança analítica e diluído em ácido clorídrico em pH tamponado em um erlenmeyer de 250 mL. A solução preparada foi titulada e gastou-se 16,37 mL de solução de EDTA de concentração desconhecida. Qual a concentração da solução de EDTA?

I, apenas
I, II e III
I e II, apenas
II e III, apenas
II, apenas
O rótulo de um produto de limpeza diz que a concentração de amônia (NH3) é de 9,5 g/L. Com o intuito de verificar se a concentração de amônia corresponde à indicada no rótulo, 5,00 mL desse produto foram titulados com ácido clorídrico de concentração 0,100 mol/L. Para consumir toda a amônia dessa amostra, foram gastos 25,00 m/L do ácido.
(Dados: H = 1, N = 14 e Cl = 35,5.) Com base nas informações fornecidas acima:
Qual a concentração da solução, calculada com os dados da titulação? A concentração indicada no rótulo é correta?
0,50 mol/L – não
0,25 mol/L – sim
0,50 mol/L – sim
0,25 mol/L – não
0,12 mol/L – sim
O gráfico abaixo demonstra a curva de pH, criada à partir de uma titulação de um ácido e uma base. Baseado nas características da curva, podemos afirmar que as substâncias envolvidas nessa titulação de neutralização são:

Titulante: HCl ; Titulado: Mg(OH)2
Titulante: NaOH ; Titulado: HCl
Titulante: Ba(OH)2 ; Titulado: HCl
Titulante: H3PO4 ; Titulado: NaOH
Titulante: NaOH ; Titulado: H2SO4
A titulação de 50mL de uma base forte com ácido forte 0,1mol/L, que reagem com estequiometria 1:1, pode ser representada através do gráfico, onde P.E. = ponto de equivalência.

Considerando a informação dada, assinale a alternativa correta.
O pH no P.E. é 12,0
A concentração da base é 0,05 mol/L
O pH da base é 12,7
A concentração da base é 1,0 mol/L
A concentração da base é 0,01 mol/L
Com o objetivo de determinar a concentração molar de uma solução aquosa de NaOH, um analista químico procedeu a titulação de 50 mL dessa solução com solução aquosa de H2SO4 0,10 molar, consumindo na equivalência, 25 mL do titulante. A concentração molar solução analisada, é:
0,05
0,25
0,10
0,20
0,15
Uma alíquota de 100,0 mL de uma amostra de água contendo Ca(II) e Mg(II) é titulada com 22,74 mL de EDTA 0,00998 mols/L em pH 10,0. Outra alíquota de 100,0 mL da mesma amostra é tratada com NaOH para precipitar Mg(OH)2 e é então titulada em pH 13 com 15,86 mL da mesma solução de EDTA. Calcule a dureza total (mg/L de CaCO3). Dados: CaCO3 = 100,09 g/mol
573,65 mg/L de CaCO3
226,94 mg/L de CaCO3
345,39 mg/L de CaCO3
984,54 mg/L de CaCO3
653,89 mg/L de CaCO3
Para um químico analítico, determinar a concentração de íons metálicos em soluções aquosas é muito importante. Com esse objetivo um aluno do curso de licenciatura em química misturou duas soluções padrões de Zn2+ e Ca2+. De forma que agora terá que determinar a concentração de cada espécie na solução. Para isso o aluno fez uma titulação utilizando 50 mL de amostra da mistura gastando 28,11 mL de outra solução padrão de EDTA 0,01381 M. Outra alíquota da amostra de igual volume foi tratada com uma solução de KCN para mascarar o zinco presente na amostra. Assim procedeu-se a titulação com a mesma solução de EDTA tendo gasto 14,38 mL de solução. Qual foi a concentração de Zn2+ encontrada na amostra?
[Zn2+] = 3,81 . 10-3 mol/L
[Zn2+] = 3,81 . 10-5 mol/L
[Zn2+] = 3,81 . 10-2 mol/L
[Zn2+] = 3,81 . 10-1 mol/L
[Zn2+] = 3,81 . 10-4 mol/L
Uma das aplicações da titulometria de complexação é a determinação da concentração de um agente como o EDTA. Para esse fim utiliza-se um reagente de padrão analítico como o carbonato de magnésio. Uma amostra de 0,136 g de MgCO3 foi pesado em balança analítica e diluído em ácido clorídrico em pH tamponado em um erlenmeyer de 250 mL. A solução preparada foi titulada e gastou-se 16,37 mL de solução de EDTA de concentração desconhecida. Qual a concentração da solução de EDTA?
0,50 mol/L – não
0,25 mol/L – sim
0,50 mol/L – sim
0,25 mol/L – não
0,12 mol/L – sim
O gráfico abaixo demonstra a curva de pH, criada à partir de uma titulação de um ácido e uma base. Baseado nas características da curva, podemos afirmar que as substâncias envolvidas nessa titulação de neutralização são:

Titulante: HCl ; Titulado: Mg(OH)2
Titulante: NaOH ; Titulado: HCl
Titulante: Ba(OH)2 ; Titulado: HCl
Titulante: H3PO4 ; Titulado: NaOH
Titulante: NaOH ; Titulado: H2SO4
A titulação de 50mL de uma base forte com ácido forte 0,1mol/L, que reagem com estequiometria 1:1, pode ser representada através do gráfico, onde P.E. = ponto de equivalência.

Considerando a informação dada, assinale a alternativa correta.
O pH no P.E. é 12,0
A concentração da base é 0,05 mol/L
O pH da base é 12,7
A concentração da base é 1,0 mol/L
A concentração da base é 0,01 mol/L
Com o objetivo de determinar a concentração molar de uma solução aquosa de NaOH, um analista químico procedeu a titulação de 50 mL dessa solução com solução aquosa de H2SO4 0,10 molar, consumindo na equivalência, 25 mL do titulante. A concentração molar solução analisada, é:
0,05
0,25
0,10
0,20
0,15
Uma alíquota de 100,0 mL de uma amostra de água contendo Ca(II) e Mg(II) é titulada com 22,74 mL de EDTA 0,00998 mols/L em pH 10,0. Outra alíquota de 100,0 mL da mesma amostra é tratada com NaOH para precipitar Mg(OH)2 e é então titulada em pH 13 com 15,86 mL da mesma solução de EDTA. Calcule a dureza total (mg/L de CaCO3). Dados: CaCO3 = 100,09 g/mol
573,65 mg/L de CaCO3
226,94 mg/L de CaCO3
345,39 mg/L de CaCO3
984,54 mg/L de CaCO3
653,89 mg/L de CaCO3
Para um químico analítico, determinar a concentração de íons metálicos em soluções aquosas é muito importante. Com esse objetivo um aluno do curso de licenciatura em química misturou duas soluções padrões de Zn2+ e Ca2+. De forma que agora terá que determinar a concentração de cada espécie na solução. Para isso o aluno fez uma titulação utilizando 50 mL de amostra da mistura gastando 28,11 mL de outra solução padrão de EDTA 0,01381 M. Outra alíquota da amostra de igual volume foi tratada com uma solução de KCN para mascarar o zinco presente na amostra. Assim procedeu-se a titulação com a mesma solução de EDTA tendo gasto 14,38 mL de solução. Qual foi a concentração de Zn2+ encontrada na amostra?
[Zn2+] = 3,81 . 10-3 mol/L
[Zn2+] = 3,81 . 10-5 mol/L
[Zn2+] = 3,81 . 10-2 mol/L
[Zn2+] = 3,81 . 10-1 mol/L
[Zn2+] = 3,81 . 10-4 mol/L
Uma das aplicações da titulometria de complexação é a determinação da concentração de um agente como o EDTA. Para esse fim utiliza-se um reagente de padrão analítico como o carbonato de magnésio. Uma amostra de 0,136 g de MgCO3 foi pesado em balança analítica e diluído em ácido clorídrico em pH tamponado em um erlenmeyer de 250 mL. A solução preparada foi titulada e gastou-se 16,37 mL de solução de EDTA de concentração desconhecida. Qual a concentração da solução de EDTA?

Titulante: HCl ; Titulado: Mg(OH)2
Titulante: NaOH ; Titulado: HCl
Titulante: Ba(OH)2 ; Titulado: HCl
Titulante: H3PO4 ; Titulado: NaOH
Titulante: NaOH ; Titulado: H2SO4
A titulação de 50mL de uma base forte com ácido forte 0,1mol/L, que reagem com estequiometria 1:1, pode ser representada através do gráfico, onde P.E. = ponto de equivalência.

Considerando a informação dada, assinale a alternativa correta.
O pH no P.E. é 12,0
A concentração da base é 0,05 mol/L
O pH da base é 12,7
A concentração da base é 1,0 mol/L
A concentração da base é 0,01 mol/L
Com o objetivo de determinar a concentração molar de uma solução aquosa de NaOH, um analista químico procedeu a titulação de 50 mL dessa solução com solução aquosa de H2SO4 0,10 molar, consumindo na equivalência, 25 mL do titulante. A concentração molar solução analisada, é:
0,05
0,25
0,10
0,20
0,15
Uma alíquota de 100,0 mL de uma amostra de água contendo Ca(II) e Mg(II) é titulada com 22,74 mL de EDTA 0,00998 mols/L em pH 10,0. Outra alíquota de 100,0 mL da mesma amostra é tratada com NaOH para precipitar Mg(OH)2 e é então titulada em pH 13 com 15,86 mL da mesma solução de EDTA. Calcule a dureza total (mg/L de CaCO3). Dados: CaCO3 = 100,09 g/mol
573,65 mg/L de CaCO3
226,94 mg/L de CaCO3
345,39 mg/L de CaCO3
984,54 mg/L de CaCO3
653,89 mg/L de CaCO3
Para um químico analítico, determinar a concentração de íons metálicos em soluções aquosas é muito importante. Com esse objetivo um aluno do curso de licenciatura em química misturou duas soluções padrões de Zn2+ e Ca2+. De forma que agora terá que determinar a concentração de cada espécie na solução. Para isso o aluno fez uma titulação utilizando 50 mL de amostra da mistura gastando 28,11 mL de outra solução padrão de EDTA 0,01381 M. Outra alíquota da amostra de igual volume foi tratada com uma solução de KCN para mascarar o zinco presente na amostra. Assim procedeu-se a titulação com a mesma solução de EDTA tendo gasto 14,38 mL de solução. Qual foi a concentração de Zn2+ encontrada na amostra?
[Zn2+] = 3,81 . 10-3 mol/L
[Zn2+] = 3,81 . 10-5 mol/L
[Zn2+] = 3,81 . 10-2 mol/L
[Zn2+] = 3,81 . 10-1 mol/L
[Zn2+] = 3,81 . 10-4 mol/L
Uma das aplicações da titulometria de complexação é a determinação da concentração de um agente como o EDTA. Para esse fim utiliza-se um reagente de padrão analítico como o carbonato de magnésio. Uma amostra de 0,136 g de MgCO3 foi pesado em balança analítica e diluído em ácido clorídrico em pH tamponado em um erlenmeyer de 250 mL. A solução preparada foi titulada e gastou-se 16,37 mL de solução de EDTA de concentração desconhecida. Qual a concentração da solução de EDTA?

O pH no P.E. é 12,0
A concentração da base é 0,05 mol/L
O pH da base é 12,7
A concentração da base é 1,0 mol/L
A concentração da base é 0,01 mol/L
Com o objetivo de determinar a concentração molar de uma solução aquosa de NaOH, um analista químico procedeu a titulação de 50 mL dessa solução com solução aquosa de H2SO4 0,10 molar, consumindo na equivalência, 25 mL do titulante. A concentração molar solução analisada, é:
0,05
0,25
0,10
0,20
0,15
Uma alíquota de 100,0 mL de uma amostra de água contendo Ca(II) e Mg(II) é titulada com 22,74 mL de EDTA 0,00998 mols/L em pH 10,0. Outra alíquota de 100,0 mL da mesma amostra é tratada com NaOH para precipitar Mg(OH)2 e é então titulada em pH 13 com 15,86 mL da mesma solução de EDTA. Calcule a dureza total (mg/L de CaCO3). Dados: CaCO3 = 100,09 g/mol
573,65 mg/L de CaCO3
226,94 mg/L de CaCO3
345,39 mg/L de CaCO3
984,54 mg/L de CaCO3
653,89 mg/L de CaCO3
Para um químico analítico, determinar a concentração de íons metálicos em soluções aquosas é muito importante. Com esse objetivo um aluno do curso de licenciatura em química misturou duas soluções padrões de Zn2+ e Ca2+. De forma que agora terá que determinar a concentração de cada espécie na solução. Para isso o aluno fez uma titulação utilizando 50 mL de amostra da mistura gastando 28,11 mL de outra solução padrão de EDTA 0,01381 M. Outra alíquota da amostra de igual volume foi tratada com uma solução de KCN para mascarar o zinco presente na amostra. Assim procedeu-se a titulação com a mesma solução de EDTA tendo gasto 14,38 mL de solução. Qual foi a concentração de Zn2+ encontrada na amostra?
[Zn2+] = 3,81 . 10-3 mol/L
[Zn2+] = 3,81 . 10-5 mol/L
[Zn2+] = 3,81 . 10-2 mol/L
[Zn2+] = 3,81 . 10-1 mol/L
[Zn2+] = 3,81 . 10-4 mol/L
Uma das aplicações da titulometria de complexação é a determinação da concentração de um agente como o EDTA. Para esse fim utiliza-se um reagente de padrão analítico como o carbonato de magnésio. Uma amostra de 0,136 g de MgCO3 foi pesado em balança analítica e diluído em ácido clorídrico em pH tamponado em um erlenmeyer de 250 mL. A solução preparada foi titulada e gastou-se 16,37 mL de solução de EDTA de concentração desconhecida. Qual a concentração da solução de EDTA?
0,05
0,25
0,10
0,20
0,15
Uma alíquota de 100,0 mL de uma amostra de água contendo Ca(II) e Mg(II) é titulada com 22,74 mL de EDTA 0,00998 mols/L em pH 10,0. Outra alíquota de 100,0 mL da mesma amostra é tratada com NaOH para precipitar Mg(OH)2 e é então titulada em pH 13 com 15,86 mL da mesma solução de EDTA. Calcule a dureza total (mg/L de CaCO3). Dados: CaCO3 = 100,09 g/mol
573,65 mg/L de CaCO3
226,94 mg/L de CaCO3
345,39 mg/L de CaCO3
984,54 mg/L de CaCO3
653,89 mg/L de CaCO3
Para um químico analítico, determinar a concentração de íons metálicos em soluções aquosas é muito importante. Com esse objetivo um aluno do curso de licenciatura em química misturou duas soluções padrões de Zn2+ e Ca2+. De forma que agora terá que determinar a concentração de cada espécie na solução. Para isso o aluno fez uma titulação utilizando 50 mL de amostra da mistura gastando 28,11 mL de outra solução padrão de EDTA 0,01381 M. Outra alíquota da amostra de igual volume foi tratada com uma solução de KCN para mascarar o zinco presente na amostra. Assim procedeu-se a titulação com a mesma solução de EDTA tendo gasto 14,38 mL de solução. Qual foi a concentração de Zn2+ encontrada na amostra?
[Zn2+] = 3,81 . 10-3 mol/L
[Zn2+] = 3,81 . 10-5 mol/L
[Zn2+] = 3,81 . 10-2 mol/L
[Zn2+] = 3,81 . 10-1 mol/L
[Zn2+] = 3,81 . 10-4 mol/L
Uma das aplicações da titulometria de complexação é a determinação da concentração de um agente como o EDTA. Para esse fim utiliza-se um reagente de padrão analítico como o carbonato de magnésio. Uma amostra de 0,136 g de MgCO3 foi pesado em balança analítica e diluído em ácido clorídrico em pH tamponado em um erlenmeyer de 250 mL. A solução preparada foi titulada e gastou-se 16,37 mL de solução de EDTA de concentração desconhecida. Qual a concentração da solução de EDTA?
573,65 mg/L de CaCO3
226,94 mg/L de CaCO3
345,39 mg/L de CaCO3
984,54 mg/L de CaCO3
653,89 mg/L de CaCO3
Para um químico analítico, determinar a concentração de íons metálicos em soluções aquosas é muito importante. Com esse objetivo um aluno do curso de licenciatura em química misturou duas soluções padrões de Zn2+ e Ca2+. De forma que agora terá que determinar a concentração de cada espécie na solução. Para isso o aluno fez uma titulação utilizando 50 mL de amostra da mistura gastando 28,11 mL de outra solução padrão de EDTA 0,01381 M. Outra alíquota da amostra de igual volume foi tratada com uma solução de KCN para mascarar o zinco presente na amostra. Assim procedeu-se a titulação com a mesma solução de EDTA tendo gasto 14,38 mL de solução. Qual foi a concentração de Zn2+ encontrada na amostra?
[Zn2+] = 3,81 . 10-3 mol/L
[Zn2+] = 3,81 . 10-5 mol/L
[Zn2+] = 3,81 . 10-2 mol/L
[Zn2+] = 3,81 . 10-1 mol/L
[Zn2+] = 3,81 . 10-4 mol/L
Uma das aplicações da titulometria de complexação é a determinação da concentração de um agente como o EDTA. Para esse fim utiliza-se um reagente de padrão analítico como o carbonato de magnésio. Uma amostra de 0,136 g de MgCO3 foi pesado em balança analítica e diluído em ácido clorídrico em pH tamponado em um erlenmeyer de 250 mL. A solução preparada foi titulada e gastou-se 16,37 mL de solução de EDTA de concentração desconhecida. Qual a concentração da solução de EDTA?
[Zn2+] = 3,81 . 10-3 mol/L
[Zn2+] = 3,81 . 10-5 mol/L
[Zn2+] = 3,81 . 10-2 mol/L
[Zn2+] = 3,81 . 10-1 mol/L
[Zn2+] = 3,81 . 10-4 mol/L